လူ့ခန္ဓာကိုယ်ထဲမှာပရိုတိန်း၏အခန်းကဏ္.ကို

ခန္ဓာကိုယ်အတွက်ပရိုတိန်းများ၏ကြီးကျယ်ခမ်းနားမှုသည် ၄ င်းတို့၏လုပ်ငန်းဆောင်တာများကြောင့်ဖြစ်သည်။
တင်ပြထားသောပရိုတိန်း၏အခြေခံလုပ်ဆောင်ချက်များသည်ပုံမှန်လူနေမှုဘ ၀ ကိုသေချာစေရန်ဤအရာ ၀ တ္ထုများ၏အရေးပါမှုကိုဖော်ပြသည်။
၁၉ ရာစုတွင်သိပ္ပံပညာရှင်များကဤသို့ဖော်ပြခဲ့သည် -
- ပရိုတိန်းအလောင်းတွေဟာထူးခြားတယ်၊
- သက်ရှိနှင့်ပတ်ဝန်းကျင်အကြားအမြဲတမ်းဇီဝြဖစ်ပျက်မှုလိုအပ်သည်။
ဤပြဌာန်းချက်များသည်ပစ္စုပ္ပန်နှင့်မပြောင်းလဲပါ။
ပရိုတိန်း၏အခြေခံဖွဲ့စည်းမှု
ပရိုတိန်းဟုခေါ်သောရိုးရှင်းသောပရိုတင်းတစ်ခု၏ကြီးမားသောမော်လီကျူးယူနစ်များသည်ဓာတုဗေဒဆိုင်ရာချိတ်ဆက်ထားသောသေးငယ်သည့်လုပ်ကွက်များ - အမိုင်နိုအက်ဆစ်များနှင့်တူညီပြီးမတူညီသောအပိုင်းအစများဖြင့်ဖွဲ့စည်းသည်။ ထိုကဲ့သို့သောဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာဖွဲ့စည်းမှု heteropolymers ဟုခေါ်ကြသည်။ အမိုင်နိုအက်ဆစ်များထဲမှကိုယ်စားလှယ် ၂၀ ကိုသာသဘာဝပရိုတင်းများတွင်တွေ့နိုင်သည်။ ပရိုတိန်း၏ဖွဲ့စည်းမှုကိုကာဗွန် (C)၊ နိုက်ထရိုဂျင် (N)၊ ဟိုက်ဒရိုဂျင် (H)၊ အောက်ဆီဂျင် (O. Sulfur - S) တို့ကိုမကြာခဏတွေ့ရှိရပါသည်။ ထို့ကြောင့် phosphorus - P, copper - Cu, iron - Fe, iodine - I, selenium - Se သည်သူတို့၏ဖွဲ့စည်းမှုတွင်ပါဝင်နိုင်ပါသည်။
သဘာဝအပရိုတိန်း၏ Aminocarboxylic အက်ဆစ်များကိုဓာတုဖွဲ့စည်းပုံနှင့်ဇီဝဗေဒဆိုင်ရာအရေးပါမှုတို့ဖြင့်ခွဲခြားထားသည်။ ဓာတုဗေဒဆိုင်ရာခွဲခြားသတ်မှတ်မှုသည်ဓာတုဗေဒပညာရှင်များအတွက်အရေးပါသည်။
လူ့ကိုယ်ခန္ဓာတွင်အသွင်ပြောင်းလဲမှုစီးဆင်းမှုနှစ်မျိုးအမြဲရှိသည်။
- အစားအစာထုတ်ကုန်များပျက်စီးခြင်း၊ ဓာတ်တိုးခြင်း၊
- အသစ်သောမရှိမဖြစ်လိုအပ်သောတ္ထုများဇီဝပေါင်းစပ်။
သဘာဝပရိုတိန်းတွင်အစဉ်အမြဲတွေ့ရှိရသောအမိုင်နိုအက်ဆစ် ၁၂ ကိုလူ့ခန္ဓာကိုယ်၏ဇီဝဗေဒဆိုင်ရာပေါင်းစပ်မှုဖြင့်ဖန်တီးနိုင်သည်။ သူတို့ကိုအပြန်အလှန်ဖလှယ်လို့ရတယ်။
အမိုင်နိုအက်ဆစ် ၈ လုံးကိုလူသားများတွင်ဘယ်သောအခါမျှမဖန်တီးပါ။ ၎င်းတို့သည်မရှိမဖြစ်လိုအပ်ပြီးအစားအစာနှင့်မှန်မှန်ပေးသင့်သည်။
မရှိမဖြစ်လိုအပ်သောအမိုင်နို - ကာဗွန်အက်ဆစ်များရှိနေခြင်းအရပရိုတိန်းများကိုနှစ်မျိုးခွဲခြားသည်။
- ပရိုတိန်းအပြည့်၌လူ့ခန္ဓာကိုယ်လိုအပ်သည့်အမိုင်နိုအက်ဆစ်အားလုံးရှိသည်။ လိုအပ်သောအမိုင်နိုအက်ဆစ်များထဲတွင်အိမ်တွင်းဒိန်ခဲ၊ နို့ထွက်ပစ္စည်းများ၊ ကြက်၊ အမဲသား၊ ပင်လယ်နှင့်ရေချိုငါးများ၊ ဥများပါ ၀ င်သည်။
- ချို့တဲ့သောပရိုတိန်းများတွင်အရေးကြီးသောအက်ဆစ်တစ်ခုသို့မဟုတ်တစ်ခုထက် ပို၍ လိုအပ်နေနိုင်သည်။ ဤရွေ့ကားအပင်ပရိုတိန်းပါဝင်သည်။
အစားအစာပရိုတိန်းများ၏အရည်အသွေးကိုအကဲဖြတ်ရန်ဆေးဘက်ဆိုင်ရာကမ္ဘာ့အသိုင်းအဝိုင်းက၎င်းတို့အားလိုအပ်သောနှင့်မရှိမဖြစ်လိုအပ်သောအမိုင်နိုအက်ဆစ်များအချိုးအစားကိုတင်းကြပ်စွာစစ်ဆေးသည့်“ စံပြ” ပရိုတိန်းနှင့်နှိုင်းယှဉ်သည်။ သဘာဝတွင်“ စံပြ” ပရိုတင်းတစ်မျိုးမတည်ရှိပါ။ တိရိစ္ဆာန်ပရိုတိန်းအဖြစ်သူ့ကိုအဖြစ်။ အပင်ပရိုတင်းများသည်များသောအားဖြင့်အမိုင်နိုအက်ဆစ်တစ်ခု (သို့) တစ်ခုထက်ပိုသောစံများစုစည်းခြင်းနှင့်မလုံလောက်ပါ။ ပျောက်နေသောပစ္စည်းကိုထည့်လိုက်လျှင်ပရိုတိန်းသည်ပြည့်စုံသွားလိမ့်မည်။
အပင်နှင့်တိရိစ္ဆာန်များ၏ပရိုတိန်း၏အဓိကရင်းမြစ်များ
အစားအစာဓာတုဗေဒနှင့် ပတ်သက်၍ ကျယ်ကျယ်ပြန့်ပြန့်လေ့လာမှုပြုသည့်ပြည်တွင်းသိပ္ပံပညာရပ်အသိုင်းအဝိုင်းတွင်ပါမောက္ခအေ။ ပီ။ နီချာနှင့်သူ့လုပ်ဖော်ကိုင်ဖက်များနှင့်ကျောင်းသားများသည်ထင်ရှားသည်။ ရုရှားဈေးကွက်တွင်ရရှိနိုင်သည့်အဓိကအစားအစာထုတ်ကုန်များတွင်ပရိုတင်းပါဝင်မှုကိုအဖွဲ့ကဆုံးဖြတ်ခဲ့သည်။
- အရေးကြီးတယ်။ ခွဲခြားသတ်မှတ်ထားသောကိန်းဂဏန်းများသည်ထုတ်ကုန်၏ ၁၀၀ ဂရမ်ရှိပရိုတင်းပါဝင်မှုကိုအသိပေးသည်။
- ပရိုတင်းအများဆုံးပမာဏကိုပဲပုပ်၊ ရွှေဖရုံသီးနှင့်မြေပဲတွင်တွေ့ရှိရသည် (၃၄.၉ - ၂၆.၃ ဂ) ။
- ၂၀ မှ ၃၀ ဂရမ်အထိတန်ဖိုးများကိုပဲ၊ ပဲများ၊ ပစ္စတိုရှစ်နှင့်နေကြာစေ့များတွင်တွေ့ရသည်။
- အခွံမာသီး၊ အခွံမာသီးသည် ၁၅ မှ ၂၀ မှဂရမ်အထိရှိသည်။
- (ဆန်၊ ပြောင်းဖူး မှလွဲ၍) သီးနှံအများစုသည်အခွံမာသီး ၁၀၀ လျှင် ၁၀ ဂရမ်မှ ၁၅ ဂရမ်အထိပါဝင်သည်။
- ဆန်၊ ပြောင်းဖူးစေ့၊ ပေါင်မုန့်၊ ကြက်သွန်ဖြူ၊ apricots အခြောက်များသည် ၅ မှ ၁၀ ဂရမ်အထိကျသည်။
- ဂေါ်ဖီထုပ်၊ မှိုများ၊ အာလူး၊ တံစဉ်များကို ၁၀၀ ဂရမ်၊ အချို့သော beet မျိုးများ၌ပရိုတင်းပါဝင်မှုသည် ၂ ဂရမ်မှ ၅ ဂရမ်အထိရှိသည်။
- စပျစ်သီးပျဉ်, မုန်လာဥ, မုန်လာဥ, ငရုတ်ကောင်းပရိုတိန်းအနည်းငယ်သာရှိသည်, သူတို့ရဲ့ညွှန်းကိန်း 2 ဂရမ်ထက်မပိုပါဘူး။
သင်ဒီမှာအပင်တစ်ပင်ကိုရှာမတွေ့ဘူးဆိုရင်အဲဒီမှာရှိတဲ့ပရိုတင်းဓာတ်ပါဝင်မှုဟာအရမ်းနည်းလွန်းတယ်၊ ဒါမှမဟုတ်လုံးဝမရှိဘူး။ ဥပမာအားဖြင့်၊ သစ်သီးဖျော်ရည်များတွင်သဘာဝဟင်းသီးဟင်းရွက်ဆီများ၌ပရိုတင်းအနည်းငယ်သာရှိသည်၊
- အမြင့်ဆုံးပရိုတင်းပါဝင်မှုကိုငါးဥများ၊ မာကျော။ ပြုပြင်ထားသောဒိန်ခဲများနှင့်ယုန်အသားများ (၂၁.၁ မှ ၂၈.၉ ဂရမ်) တွင်တွေ့ရှိရသည်။
- ထုတ်ကုန်များစွာတွင်ပရိုတင်း ၁၅ မှ ၁၀ ဂရမ်မှပါ ၀ င်သည်။ ဤသည်မှာငှက်၊ ပင်လယ်ငါး (capelin မှအပ)၊ နွားသား၊ ပုစွန်၊ ပြည်ကြီးငါး၊ အိမ်တွင်းဒိန်ခဲ၊ feta ဒိန်ခဲ၊ ရေချိုငါးဖြစ်သည်။
- ကြက်ဥကြက်ဥ၊ ဝက်သားတွင်ထုတ်ကုန် ၁၀၀ ဂရမ်လျှင် ၁၂.၇ မှ ၁၅ ဂရမ်ပရိုတင်းပါဝင်သည်။
- ဒိန်ချဉ်, ဒိန်ခဲ 5 - 7.1 gr နံပါတ်များဖြင့်သွင်ပြင်လက္ခဏာရှိသည်။
- နို့၊ ကဖေး၊ အချဉ်ဖောက်ထားသောနို့၊ အချဉ်၊ မုန့်တွင်ပရိုတင်း ၂.၈ မှ ၃ ဂရမ်ပါဝင်သည်။
စက်ရုံနှင့်တိရစ္ဆာန်အပင်များ၏ပရိုတိန်း၏အဓိကအရင်းအမြစ်များနှင့်ပတ်သက်သည့်သတင်းအချက်အလက်များကိုအဆင့်ဆင့်နည်းပညာဆိုင်ရာပြုပြင်ပြောင်းလဲမှု (စွပ်ပြုတ်၊ ဝက်အူချောင်း၊ ဝက်ပေါင်ခြောက်၊ ဝက်အူချောင်း) ခံယူသည်။ ပုံမှန်ကျန်းမာရေးနှင့်ညီညွတ်သောအစာစားရန်အတွက်၎င်းတို့အားမတိုက်တွန်းပါ။ ထိုကဲ့သို့သောထုတ်ကုန်များ၏ရေတိုအသုံးပြုမှုကိုသိသိသာသာမဟုတ်ပါဘူး။
အာဟာရအတွက်ပရိုတိန်း၏အခန်းကဏ္.ကို
ခန္ဓာကိုယ်အတွင်းရှိဇီဝဖြစ်စဉ်ဖြစ်စဉ်၏ရလဒ်အနေဖြင့်၊ အဟောင်းများကိုအစားပရိုတိန်းမော်လီကျူးအသစ်များသည်အဆက်မပြတ်ဖြစ်ပေါ်သည်။ ကွဲပြားခြားနားသောကိုယ်တွင်းအင်္ဂါများတွင်ပေါင်းစပ်မှုနှုန်းတူညီသည်မဟုတ်။ ဥပမာအားဖြင့်အင်ဆူလင်ဟော်မုန်းပရိုတိန်းများသည်နာရီ၊ မိနစ်အနည်းငယ်အတွင်း (ပြန်လည်တည်ဆောက်ခြင်း) ကိုပြန်လည်လျှင်မြန်စွာပြန်လည်ရောက်ရှိစေသည်။ ၁၀ ရက်အတွင်းအသည်းပရိုတင်းများ၊ ဦး နှောက်၊ ကြွက်သားများနှင့်ဆက်နွယ်သည့်တစ်သျှူးများ၏ပရိုတင်းမော်လီကျူးများကိုကြာရှည်စွာပြန်လည်ထူထောင်ပေးသည်။ ပြန်လည်ထူထောင်ရေး (ပြန်လည်ဖွဲ့စည်းခြင်း) သည်ခြောက်လအထိကြာနိုင်သည်။
အသုံးပြုခြင်းနှင့်ပေါင်းစပ်ခြင်း၏ဖြစ်စဉ်ကိုနိုက်ထရိုဂျင်ချိန်ခွင်လျှာဖြင့်ဖော်ပြသည်။
- ကျန်းမာရေးနှင့်ပြည့်စုံသောလူတစ်ယောက်တွင်နိုက်ထရိုဂျင်ချိန်ခွင်လျှာသည်သုညဖြစ်သည်။ ဤကိစ္စတွင်အာဟာရရှိစဉ်ပရိုတိန်းများနှင့်အတူနိုက်ထရိုဂျင်သည်စုစုပေါင်းအစုလိုက်အပြုံလိုက်ပုပ်ပျက်သောထုတ်ကုန်များနှင့်ထုတ်လွှတ်သောဒြပ်ထုနှင့်တူညီသည်။
- နုပျိုသောသက်ရှိများသည်လျင်မြန်စွာတိုးတက်နေသည်။ နိုက်ထရိုဂျင်ချိန်ခွင်သည်အပြုသဘောဆောင်သည်။ ပရိုတိန်းတွေအများကြီးရှိတယ်။
- အိုမင်းနေတဲ့ဖျားနာသူတွေဟာနိုက်ထရိုဂျင်ချိန်ခွင်လျှာဟာအနုတ်လက္ခဏာဆောင်တယ်။ ဇီဝဖြစ်စဉ်ထုတ်ကုန်များနှင့်ထုတ်လွှတ်သောနိုက်ထရိုဂျင်သည်အစားအစာစားသုံးခြင်းနှင့်ရရှိသောပမာဏထက်များနေသည်။
အာဟာရတွင်ပရိုတိန်း၏အခန်းကဏ္ role သည်လူတစ် ဦး အားခန္ဓာကိုယ်၏ဇီဝဓာတုဗေဒဆိုင်ရာလုပ်ငန်းစဉ်များတွင်ပါ ၀ င်ရန်သင့်လျော်သောအမိုင်နိုအက်ဆစ်အစိတ်အပိုင်းများကိုပေးရန်ဖြစ်သည်။
ပုံမှန်ဇီဝြဖစ်ပျက်မှုသေချာစေရန်လူတစ် ဦး သည်တစ်နေ့လျှင်ပရိုတင်းမည်မျှလိုအပ်သည်ကိုသိရန်အရေးကြီးသည်။
အိမ်တွင်းနှင့်အမေရိကန်ဇီဝကမ္မဗေဒပညာရှင်များသည်လူတစ် ဦး ၏အလေးချိန် ၁ ကီလိုလျှင် ၁.၈ မှ ၁ ဂဂရမ်ရှိသည့်ပရိုတင်းကိုစားသုံးရန်အကြံပြုသည်။ အဆိုပါနံပါတ်များကိုအတော်လေးပျမ်းမျှနေကြသည်။ ပမာဏသည်အသက်၊ အလုပ်သဘောသဘာဝ၊ လူတစ် ဦး ၏နေထိုင်မှုပုံစံပေါ်မူတည်သည်။ ပျမ်းမျှအားဖြင့်တစ်နေ့လျှင်ပရိုတင်း ၆၀ ဂရမ်မှ ၁၀၀ ဂရမ်မှစားသုံးရန်အကြံပြုသည်။ ရုပ်ပိုင်းဆိုင်ရာအလုပ်များတွင်ပါဝင်သောအမျိုးသားများအတွက်ပုံမှန်နှုန်းကိုတစ်နေ့လျှင် ၁၂၀ ဂရမ်အထိတိုးမြှင့်နိုင်သည်။ ခွဲစိတ်ကုသမှုခံယူသူများအတွက်ကူးစက်ရောဂါများအတွက်ပုံမှန်နှုန်းသည်တစ်နေ့လျှင် ၁၄၀ ဂရမ်အထိတိုးလာသည်။ ဆီးချိုရောဂါသည်တစ်နေ့လျှင် ၁၄၀ ဂရမ်ထိရောက်ရှိနိုင်သောပရိုတင်းထုတ်ကုန်များများပါသောအစားအစာများဖြစ်သည်။ ဇီဝဖြစ်ပျက်ခြင်းဆိုင်ရာရောဂါများဖြစ်သောဂေါက်ရောဂါကိုဖြစ်ပေါ်စေသောသူများသည်ပရိုတင်းဓာတ်များကိုလျော့နည်းစွာသုံးစွဲသင့်သည်။ သူတို့အတွက်စံသည်တစ်နေ့လျှင် ၂၀ မှ ၄၀ ဂရမ်ဖြစ်သည်။
ကြွက်သားထုထည်တိုးစေသောတက်ကြွသောအားကစားများတွင်ပါ ၀ င်သူများအတွက်စံသည်သိသိသာသာတိုးလာပြီးအားကစားသမားတစ် ဦး လျှင် ၁.၆ မှ ၁.၈.၈ ဂရမ်အထိရောက်ရှိနိုင်သည်။
- အရေးကြီးတယ်။ လေ့ကျင့်ခန်းလုပ်နေစဉ်တစ်နေ့လျှင်ပရိုတိန်းမည်မျှစားသုံးသင့်သည်ဟူသောမေးခွန်း၏အဖြေကိုရှင်းလင်းပေးရန်သင်တန်းဆရာသည်အကြံပြုလိုသည်။ ပညာရှင်များသည်လေ့ကျင့်မှုအမျိုးအစားအားလုံးအတွက်စွမ်းအင်ကုန်ကျမှု၊ အားကစားသမား၏ကိုယ်ခန္ဓာ၏ပုံမှန်လည်ပတ်မှုကိုထိန်းသိမ်းရန်နည်းလမ်းများရှိသည်။
အားလုံးဇီဝကမ္မလုပ်ဆောင်ချက်များကို၏အကောင်အထည်ဖော်မှုအတွက်, ပရိုတိန်းအတွက်မရှိမဖြစ်လိုအပ်သောအမိုင်နိုအက်ဆစ်၏တည်ရှိမှုမသာပေမယ့်သူတို့ရဲ့ assimilation ၏ထိရောက်မှုအရေးကြီးပါသည်။ ပရိုတင်းမော်လီကျူးများတွင်အဆင့်အမျိုးမျိုးရှိပြီးပျော်ဝင်နိုင်မှု၊ အစာကြေအင်ဇိုင်းများသို့ဝင်ရောက်နိုင်မှုအဆင့်ရှိသည်။ နို့ပရိုတင်း ၉၆ ရာခိုင်နှုန်း၊ ဥများသည်ထိထိရောက်ရောက်ကျိုးပဲ့ကြသည်။ အသား၊ ငါးများတွင်ပရိုတင်း ၉၃-၉၅% ကိုလုံခြုံစွာအစာကြေသည်။ ချွင်းချက်ကအရေပြားနှင့်ဆံပင်၏ပရိုတင်းဖြစ်သည်။ ဟင်းသီးဟင်းရွက်ပရိုတိန်းပါ ၀ င်သောထုတ်ကုန်များကို ၆၀-၈၀% ဖြင့်ကြေညက်သည်။ ဟင်းသီးဟင်းရွက်များတွင်ပရိုတင်း ၈၀ ရာခိုင်နှုန်း၊ အာလူးတွင် ၇၀%၊ ပေါင်မုန့် ၆၂-၈၆% စုပ်ယူသည်။
တိရိစ္ဆာန်ရင်းမြစ်များမှပရိုတိန်း၏ထောက်ခံမှုပမာဏသည်ပရိုတိန်းထုထည်၏စုစုပေါင်းပမာဏ၏ ၅၅% ဖြစ်သင့်သည်။
- ခန္ဓာကိုယ်ရှိပရိုတင်းဓာတ်ချို့တဲ့ခြင်းသည်သိသိသာသာဇီဝဖြစ်စဉ်ပြောင်းလဲမှုများကိုဖြစ်ပေါ်စေသည်။ ထိုကဲ့သို့သောရောဂါဗေဒ dystrophy, kwashiorkor ဟုခေါ်ကြသည်။ ပထမ ဦး ဆုံးအကြိမ်အနေဖြင့်အာဖရိကတောရိုင်းမျိုးနွယ်စုများတွင်အပျက်သဘောဆောင်သောနိုက်ထရိုဂျင်မျှတမှု၊ အူလမ်းကြောင်းလုပ်ဆောင်မှု၊ ကြွက်သားကျုံ့ခြင်း၊ တစ်စိတ်တစ်ပိုင်းပရိုတင်းဓာတ်ချို့တဲ့အလားတူရောဂါလက္ခဏာများနှင့်အတူဖြစ်ပွားနိုင်သည်အချို့သောအချိန်များအတွက်ပျော့ပျောင်းသောနိုင်ပါတယ်။ အထူးသဖြင့်ကလေး၏ကိုယ်ခန္ဓာတွင်ပရိုတင်းများမရှိခြင်းသည်အထူးအန္တရာယ်ရှိသည်။ ထိုကဲ့သို့သောအစားအသောက်မူမမှန်မှုများသည်ကြီးထွားလာသောလူတစ် ဦး ၏ကာယနှင့်ဉာဏ်ရည်အားနည်းမှုကိုဖြစ်ပေါ်စေသည်။
- ခန္ဓာကိုယ်အတွင်းရှိပရိုတိန်းအပိုများသည်ထုတ်လွှတ်သည့်စနစ်ကိုအလွန်အကျွံတင်သည်။ ကျောက်ကပ်အပေါ်ဝန်တိုးလာသည်။ ကျောက်ကပ်တစ်သျှူးအတွင်းရှိရောဂါဗေဒများနှင့်အတူလုပ်ငန်းစဉ်ပိုမိုဆိုးရွားစေနိုင်သည်။ ခန္ဓာကိုယ်အတွင်းရှိပရိုတိန်းပိုလျှံမှုသည်အခြားအဖိုးတန်အစားအစာအစိတ်အပိုင်းများမရှိခြင်းနှင့်အတူလိုက်ပါလာလျှင်အလွန်ဆိုးသည်။ ရှေးအချိန်ကအာရှနိုင်ငံများတွင်အပြစ်ရှိသူအားအသားကိုသာကျွေးမွေးရန်ကွပ်မျက်သည့်နည်းလမ်းရှိခဲ့သည်။ ရလဒ်အနေနှင့်ပြစ်မှုကျူးလွန်သူသည်အဆိပ်အတောက်ဖြစ်ပြီးနောက်အူအတွင်းပုပ်ထုတ်ကုန်များဖြစ်ပေါ်လာခြင်းကြောင့်သေဆုံးခဲ့သည်။
ခန္ဓာကိုယ်ကိုပရိုတိန်းများထောက်ပံ့ပေးခြင်းအတွက်ကျိုးကြောင်းဆီလျော်သောချဉ်းကပ်မှုသည်သက်ရှိအားလုံးစနစ်၏ထိရောက်သောလည်ပတ်မှုကိုအာမခံသည်။
လေ့လာပါ

ဒီပရိုတိန်းကို ၁၇၂၈ ခုနှစ်မှာအီတလီဂျိုကိုတိုဘာတိုလီယိုဘက်ကာရီကဂျုံမှုန့်ကနေ (gluten ပုံစံဖြင့်) ရရှိခဲ့တယ်။ ပြင်သစ်ဓာတုဗေဒ Antoine de Fourcroix နှင့်အပူသို့မဟုတ်အက်စစ်တို့၏သြဇာလွှမ်းမိုးမှုအောက်တွင် coating (ပရိုတင်း) ၏ဂုဏ်သတ္တိကိုမှတ်သားထားသောအခြားသိပ္ပံပညာရှင်များ၏ရလဒ်ကြောင့်ပရိုတိန်းများကို ၁၈ ရာစုတွင်သီးခြားဇီဝဗေဒမော်လီကျူးများခွဲထုတ်ခဲ့သည်။ ထိုအချိန်က albumin (“ egg white white”)၊ fibrin (သွေးမှပရိုတိန်း) နှင့်ဂျုံအစေ့မှ gluten စသည့်ပရိုတင်းများကိုစစ်ဆေးခဲ့သည်။
၁၉ ရာစုအစတွင်ပရိုတိန်း၏ဖွဲ့စည်းမှုဖွဲ့စည်းပုံနှင့် ပတ်သက်၍ သတင်းအချက်အလက်အချို့ရရှိပြီးဖြစ်သည်။ ဤအမိုင်နိုအက်ဆစ်အချို့ (ဥပမာ - ဂလိုင်းနှင့်လီယို) သည်သွင်ပြင်လက္ခဏာရှိသည်။ ပရိုတိန်း၏ဓာတုဖွဲ့စည်းပုံကိုခွဲခြမ်းစိတ်ဖြာခြင်းအရဒတ်ခ်ျဓာတုဗေဒပညာရှင် Gerrit Mulder သည်ပရိုတိန်းအားလုံးနီးပါးတွင်အလားတူပင်ကိုယ်မူလပုံသေနည်းရှိသည်ဟုယူဆခဲ့သည်။ ၁၈၃၆ တွင် Mulder သည်ပရိုတိန်း၏ဓာတုဖွဲ့စည်းပုံ၏ပထမဆုံးပုံစံကိုအဆိုပြုခဲ့သည်။ အစွန်းရောက်မှုသီအိုရီကိုအခြေခံပြီးပရိုတိန်း၏အနည်းဆုံးဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာယူနစ်တွင်အောက်ပါဖွဲ့စည်းမှုရှိသည်ဟုသူကထပ်မံပြုပြင်မှုများပြုလုပ်ပြီးနောက်နိဂုံးချုပ်ခဲ့သည်။40ဇ62N10အို12။ သူသည်ဤယူနစ်ကို "ပရိုတိန်း" (ဂရိမှ Proto - ပထမ၊ မူလတန်း) နှင့်ပရိုတိန်းသီအိုရီဟုခေါ်ခဲ့သည်။ ပရိုတိန်းဟူသောဝေါဟာရကိုဆွီဒင်ဓာတုဗေဒဓာတုဗေဒပညာရှင် Jacob Berzelius မှအဆိုပြုထားသည်။ Mulder ၏အဆိုအရပရိုတိန်းတစ်ခုစီတွင်ပရိုတိန်းများ၊ ဆာလ်ဖာနှင့်ဖော့စဖရပ်တို့ပါဝင်သည်။ ဥပမာအားဖြင့်သူသည် fibrin formula ကို 10PrSP အဖြစ်ရေးသားရန်အကြံပြုခဲ့သည်။ အမ်မီနိုအက်ဆစ်များသည်ပရိုတိန်းများပျက်စီးခြင်း၏ထုတ်ကုန်များကိုမှားယွင်းမှုအနည်းငယ်ဖြင့်လေ့လာခဲ့ပြီးမော်လီကျူးအလေးချိန် - 131 daltons ကိုလည်းသူကလေ့လာခဲ့သည်။ ပရိုတိန်းနှင့်ပတ်သက်သည့်အချက်အလက်အသစ်များစုဆောင်းခြင်းနှင့်အတူပရိုတိန်းသီအိုရီကိုစတင်ဝေဖန်မှုများစတင်ခဲ့သော်လည်း ၁၈၅၀ ပြည့်နှစ်များနှောင်းပိုင်းအထိ၎င်းကိုတစ်ကမ္ဘာလုံးအတိုင်းအတာဖြင့်အသိအမှတ်ပြုထားဆဲဖြစ်သည်။
၁၉ ရာစုအကုန်တွင်ပရိုတိန်းများပါဝင်သောအမိုင်နိုအက်ဆစ်အများစုကိုစုံစမ်းစစ်ဆေးခဲ့သည်။ 1880 နှောင်းပိုင်း၌တည်၏။ ရုရှားသိပ္ပံပညာရှင်အေ။ပရိုတိန်းမော်လီကျူးတွင် peptide အုပ်စုများ (CO - NH) ရှိကြောင်း Danilevsky ကမှတ်ချက်ချသည်။ ၁၈၉၄ တွင်ဂျာမန်ဇီဝကမ္မဗေဒပညာရှင်အဲလ်ဘရက်ခ်ကော့စယ်လ်ကအမိုင်နိုအက်ဆစ်များသည်ပရိုတိန်း၏အဓိကဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာဒြပ်စင်များနှင့်အညီသီအိုရီတစ်ခုကိုတင်ပြခဲ့သည်။ ၂၀ ရာစုအစတွင်ဂျာမန်ဓာတုဗေဒဓာတုဗေဒပညာရှင် Emil Fischer သည်ပရိုတိန်းသည်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များမှ peptide bonds များနှင့်ဆက်နွှယ်ကြောင်းစမ်းသပ်လေ့လာခဲ့သည်။ သူသည်ပရိုတိန်း၏အမိုင်နိုအက်ဆစ်အစီအစဉ်၏ပထမ ဦး ဆုံးခွဲခြမ်းစိတ်ဖြာမှုကိုလည်းပြုလုပ်ခဲ့ပြီး proteolysis ဖြစ်စဉ်ကိုရှင်းပြခဲ့သည်။
သို့သော်သက်ရှိများတွင်ပရိုတိန်း၏အဓိကအခန်းကဏ္19ကို ၁၉၂၆ ခုနှစ်မှစ၍ အမေရိကန်ဓာတုဗေဒပညာရှင်ဂျိမ်းစ်ဆမ်နာ (နောက်ပိုင်းတွင်ဓာတုဗေဒနိုဘယ်ဆု) က urease အင်ဇိုင်းသည်ပရိုတိန်းတစ်ခုဖြစ်ကြောင်းပြသခဲ့သည်။
စင်ကြယ်သောပရိုတိန်းများခွဲထုတ်ရာ၌အခက်အခဲကလေ့လာရန်ခက်ခဲသည်။ ထို့ကြောင့်ပထမ ဦး ဆုံးလေ့လာမှုများသည်များပြားလှသောပမာဏများ၌အလွယ်တကူသန့်စင်နိုင်သည့်သွေးပရိုတိန်းများ၊ ကြက်ဥကြက်ဥများ၊ အဆိပ်အတောက်အမျိုးမျိုးနှင့်တိရစ္ဆာန်များကိုသတ်ဖြတ်ပြီးနောက်ထွက်ပေါ်လာသောအစာခြေ / ဇီဝဖြစ်စဉ်အင်ဇိုင်းများကိုအသုံးပြုခြင်းဖြစ်သည်။ 1950 နှောင်းပိုင်းမှာတော့ကုမ္ပဏီ Armor Hot Dog Co. များစွာသောလေ့လာမှုများအတွက်စမ်းသပ်ပစ်မှတ်ဖြစ်လာသည်သော bovine ပန်ကရိယပန်ကရိယ ribonuclease A ၏တစ်ကီလိုဂရမ်ကိုရှင်းလင်းနိုင်ခဲ့သည်။
ပရိုတိန်း၏ဒုတိယဖွဲ့စည်းတည်ဆောက်ပုံသည်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များအကြားဟိုက်ဒရိုဂျင်ဆက်သွယ်မှုကိုဖြစ်ပေါ်စေသောအယူအဆကို ၁၉၃၃ ခုနှစ်တွင်ဝီလျံအက်စဘာရီကတင်ပြခဲ့သည်။ သို့သော်လီနပ်စ်ပေါလင်းသည်ပရိုတိန်း၏ဒုတိယဖွဲ့စည်းတည်ဆောက်ပုံကိုအောင်မြင်စွာကြိုတင်ခန့်မှန်းနိုင်သည့်ပထမဆုံးသိပ္ပံပညာရှင်ဖြစ်သည်။ နောက်ပိုင်း Kai Linnerstrom-Lang ၏လုပ်ငန်းကိုမှီခိုအား ထား၍ Walter Kauzman သည်ပရိုတိန်းများ၏တတိယအဆင့်ဖွဲ့စည်းပုံနှင့်ဤဖြစ်စဉ်တွင် hydrophobic interaction က၏အခန်းကဏ္ofကိုနားလည်ရန်သိသိသာသာအထောက်အကူပြုခဲ့သည်။ ၁၉၄၀ ပြည့်လွန်နှစ်များနှောင်းပိုင်းနှင့် ၁၉၅၀ အစောပိုင်းကာလများတွင်ဖရက်ဒရစ်ဆာဂါသည်ပရိုတိန်းအစီအစဉ်အတွက်နည်းစနစ်တစ်ခုကိုတီထွင်ခဲ့သည်။ သူက ၁၉၅၅ တွင်အင်ဆူလင်ချည်နှောင်မှုနှစ်ခု၏အမိုင်နိုအက်ဆစ်အစီအစဉ်ကိုဆုံးဖြတ်ခဲ့သည်၊ ) ချည်နှောင်, colloids သို့မဟုတ် cyclols ။ ဆိုဗီယက် / ရုရှားသိပ္ပံပညာရှင်များကတည်ထောင်ခဲ့သည့်အမိုင်နိုအက်ဆစ်အစဉ်လိုက်ပရိုတင်းသည် ၁၉၇၂ တွင်အက်ပါနိုအက်တီနိတ်ဖြစ်သည်။
X-Ray diffraction (X-Ray diffraction analysis) မှရရှိသောပရိုတိန်း၏ပထမ ဦး ဆုံး Spatial ဖွဲ့စည်းပုံကို ၁၉၅၀ နှောင်းပိုင်းနှင့် ၁၉၆၀ အစောပိုင်းတွင်သိရှိခဲ့ပြီး ၁၉၈၀ ပြည့်နှစ်များတွင်နျူကလီးယားသံလိုက်ပဲ့တင်ရိုက်ခတ်မှုဖြင့်ရှာဖွေတွေ့ရှိခဲ့သည်။ ၂၀၁၂ ခုနှစ်တွင်ပရိုတိန်းဒေတာဘဏ်သည်ပရိုတင်းဖွဲ့စည်းမှု ၈၇၀၀၀ ခန့်ရှိသည်။
၂၁ ရာစုတွင်ပရိုတိန်းသုတေသနသည်အရည်အသွေးအသစ်အဆင့်သို့ပြောင်းလဲသွားသည်။ တစ် ဦး ချင်းစီကိုသန့်စင်သောပရိုတိန်းများကိုသာမက၊ တစ် ဦး ချင်းစီ၏ဆဲလ်များ၊ တစ်ရှူးများသို့မဟုတ်သက်ရှိတစ်ခုလုံး၏ပရိုတိန်းများစွာ၏တစ်ပြိုင်နက်ပြောင်းလဲမှုနှင့်အရေအတွက်ပြောင်းလဲမှုတို့ကိုလည်းပြုလုပ်ခဲ့သည်။ ဒီဇီဝဓါတုဗေဒareaရိယာ proteomics ဟုခေါ်သည်။ bioinformatics နည်းလမ်းများအသုံးပြု။ က X-Ray diffraction ခွဲခြမ်းစိတ်ဖြာ၏ဒေတာကို process ပေမယ့်လည်း၎င်း၏အမိုင်နိုအက်ဆစ် sequence ကိုအပေါ်အခြေခံပြီးပရိုတိန်း၏ဖွဲ့စည်းပုံကြိုတင်ခန့်မှန်းဖို့ဖြစ်နိုင်ခြေဖြစ်လာသည်။ လက်ရှိတွင်ကြီးမားသောပရိုတိန်းရှုပ်ထွေးမှုများ၏ cryoelectron microscopy နှင့်ကွန်ပျူတာပရိုဂရမ်များသုံးပြီးပရိုတိန်း domains များ၏ Spatial အဆောက်အ ဦ များ၏ခန့်မှန်းအနုမြူဗုံးတိကျမှုချဉ်းကပ်နေကြသည်။

ပရိုတိန်းအရွယ်အစားကိုအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များသို့မဟုတ်ဒက်တလန် (မော်လီကျူးအလေးချိန်) ဖြင့်တိုင်းတာနိုင်သည်။ သို့သော်မော်လီကျူး၏အရွယ်အစားကြီးမားသောကြောင့်ပရိုတိန်းအစုလိုက်အပြုံလိုက်ကိုထုတ်လုပ်ထားသောယူနစ်များဖြစ်သောကီလိုလက်တန် (kDa) တွင်ဖော်ပြသည်။ ပျမ်းမျှအားဖြင့်တဆေးပရိုတိန်းများတွင်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန် ၄၆၆ ခုပါဝင်ပြီးမော်လီကျူးအလေးချိန်မှာ ၅၃ ကီလိုဒါပါရှိသည်။ လက်ရှိသိကြသောအကြီးဆုံးပရိုတင်း - တိုက်တေနီယမ်သည်ကြွက်သားများမှထွက်သောရလဒ်များဖြစ်သည်။ ၎င်း၏အမျိုးမျိုးသောမော်လီကျူးအလေးချိန် (isoforms) သည် ၃၀၀၀ မှ ၃၇၀၀ kDa အထိရှိသည်။ လူတစ် ဦး ၏ soleus ကြွက်သား (lat ။ Soleus) ၏ titin သည် 38,138 အမိုင်နိုအက်ဆစ်များပါဝင်သည်။
ကုန်းတွင်းပိုင်း
ပရိုတင်းများသည် amphotericity ၏ဂုဏ်သတ္တိများရှိသည်။ ဆိုလိုသည်မှာအခြေအနေပေါ် မူတည်၍ အက်ဆစ်နှင့်အခြေခံဂုဏ်သတ္တိများကိုပြသည်။ ပရိုတိန်းတွင်အက်စစ်အမိုင်နိုအက်ဆစ် (အက်စစ်အက်စစ်နှင့်အချိုမှုအက်ဆစ်) ၏ဘေးထွက်ချည်နှောင်မှုအက်တမ်အမိုင်နိုအက်စတမ်များနှင့်နိုက်ထရိုဂျင်ပါဝင်သောအခြေခံအမိုင်နိုအက်ဆစ်များ (နို့စမစ်ပါဝင်သည့်အက်စီအမ်အက်စ်) နှင့်နိုက်ထရိုဂျင်ပါ ၀ င်သောအမိုင်နိုအက်ဆစ်များ။2) arginine အနည်းငယ်နည်းပါးသောအတိုင်းအတာအထိ - ထို imidazole histidine အကြွင်းအကျန်) ။ ပရိုတိန်းတစ်ခုစီသည် isoelectric point (pI) - အလယ်အလတ်အချဉ်ဓာတ် (pH) ဖြင့်သွင်ပြင်လက္ခဏာရှိသည်။ ၎င်းပရိုတိန်း၏မော်လီကျူးများ၏စုစုပေါင်းလျှပ်စစ်ဓာတ်အားသည်သုည ဖြစ်၍၊ ထို့ကြောင့်သူတို့သည်လျှပ်စစ်နယ်ပယ် (ဥပမာ electrophoresis) ဖြင့်ရွေ့လျားခြင်းမရှိပေ။ isoelectric point တွင်ပရိုတိန်း၏ဓါတ်ကိုထိန်းသိမ်းနိုင်မှုနှင့်ပျော်ဝင်နိုင်မှုသည်အနည်းဆုံးဖြစ်သည်။ pI တန်ဖိုးသည်ပရိုတိန်းရှိအက်ဆစ်နှင့်အခြေခံအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များ၏အချိုးအစားပေါ်တွင်မူတည်သည်။ အက်စစ်အမိုင်နိုအက်စစ်အကြွင်းအကျန်များပါ ၀ င်သည့်ပရိုတိန်းများအတွက်အက်ဆိုဒီယမ် (ထိုကဲ့သို့သောပရိုတင်းများကိုအက်စစ်အက်စစ်ဟုခေါ်သည်) တွင်တည်ရှိသည်။ ) ကြားနေဆားများသည်ပရိုတိန်း၏ဓာတုအုပ်စုများ၏အိုင်းယွန်းဒီဂရီအပေါ်သက်ရောက်မှုရှိသောကြောင့်၎င်းပရိုတင်း၏ pI တန်ဖိုးသည်အိုင်ယွန်စွမ်းအားနှင့်၎င်းတည်ရှိသည့်ကြားခံဖြေရှင်းမှုအမျိုးအစားပေါ် မူတည်၍ လည်းကွဲပြားနိုင်သည်။ ဥပမာအားဖြင့်ပရိုတိန်း၏ pI ကို titration curve မှသို့မဟုတ် isoelectric focusing ဖြင့်ဆုံးဖြတ်နိုင်သည်။
ယေဘုယျအားဖြင့်ပရိုတင်းတစ်ခု၏ pI သည်လုပ်ဆောင်မှုအပေါ်မူတည်သည်။ ကျောရိုးရှိသတ္တဝါတစ်သျှူးများရှိပရိုတင်းအများစု၏ isoelectric point သည် ၅.၅ မှ ၇.၀ အထိရှိသော်လည်းအချို့ကိစ္စများတွင်တန်ဖိုးများသည်အစွန်းရောက်သောနေရာများတွင်ဖြစ်သည်။ ဥပမာအားဖြင့်၊ pepsin အတွက်၊ ပြင်းထန်သောအက်ဆစ်ဓာတ်အစာအိမ်ရှိ proteolytic အင်ဇိုင်းဖြစ်သည်။ ဖျော်ရည် pI
1, salmin အဘို့ - salmon နို့၏ပရိုတိန်းပရိုတိန်း, တစ် ဦး အင်္ဂါရပ်အာဂျင်တီးနား၏မြင့်မားသောအကြောင်းအရာဖြစ်သော - pI
12. phosphat အုပ်စုများနှင့် electrostatic အပြန်အလှန်ဆက်သွယ်မှုကြောင့် nucleic acids များနှင့်ပေါင်းစပ်သောပရိုတိန်းများသည်အဓိကပရိုတင်းများဖြစ်ကြသည်။ ထိုကဲ့သို့သောပရိုတိန်းဥပမာတစ်ခုသည် histones နှင့် protamines များဖြစ်သည်။
ပရိုတိန်းဆိုတာဘာလဲ။
ပရိုတိန်းများသည်မြင့်မားသောမော်လီကျူးအလေးချိန်ရှိသောရှုပ်ထွေးသောအော်ဂဲနစ်ဒြပ်ပေါင်းများဖြစ်ပြီးအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များကိုအထူးနည်းလမ်းဖြင့်ပေါင်းစပ်ထားသည်။ ပရိုတိန်းတစ်ခုစီတွင်ကိုယ်ပိုင်အမိုင်နိုအက်ဆစ်အစီအစဉ်ရှိသည်၊ အာကာသအတွင်းရှိ၎င်း၏တည်နေရာရှိသည်။ ခန္ဓာကိုယ်အတွင်းသို့ ၀ င်ရောက်သောပရိုတိန်းများသည်၎င်းတို့အားမပြောင်းလဲသောပုံစံဖြင့်မစုပ်ယူနိုင်ကြောင်း၊ အမိုင်နိုအက်ဆစ်များအဖြစ်ပြိုကွဲသွားသည်နှင့်သူတို့၏အကူအညီဖြင့်ကိုယ်ခန္ဓာ၏ပရိုတိန်းများကိုပေါင်းစပ်သည်ကိုနားလည်ရန်အရေးကြီးသည်။
ပရိုတိန်းများဖွဲ့စည်းခြင်းတွင်အမိုင်နိုအက်စစ် ၂၂ ခုပါ ၀ င်ပြီး၎င်းတို့အနက်မှ ၁၃ ခုကိုတစ်ခုနှင့်တစ်ခုပြောင်းလဲစေနိုင်သည်။ ခန္ဓာကိုယ်အတွင်းရှိအစားထိုးလဲလှယ်နိုင်သောအက်ဆစ်များမရှိခြင်းကိုလက်မခံနိုင်ပါ။ ၎င်းသည်ခန္ဓာကိုယ်ကိုပျက်စီးစေသည်။
ပရိုတိန်းသည်ကိုယ်ခန္ဓာထဲသို့ ၀ င်ရောက်ရုံသာမကအမိုင်နိုအက်ဆစ်များပါ ၀ င်သည်။

ပရိုတိန်းဆိုတာဘာလဲ။
ပရိုတိန်းများ (ပရိုတိန်းများ / ပိုလီပက်ပါဒိုက်များ) - အော်ဂဲနစ်ပစ္စည်းများ၊ ဆက်စပ်သောအမိုင်နိုအက်ဆစ် ၂၀ ပါ ၀ င်သည့်သဘာဝပိုလီမာများ။ ပေါင်းစပ်အမျိုးမျိုးကိုပေး။ ခန္ဓာကိုယ်သည်အပြန်အလှန်လဲလှယ်နိုင်သောအမိုင်နိုအက်ဆစ် ၁၂ ခုပေါင်းစပ်ခြင်းဖြင့်ဖြေရှင်းသည်။
ပရိုတိန်းတွင်တွေ့ရသောမရှိမဖြစ်လိုအပ်သောအမိုင်နိုအက်ဆစ် ၂၀ မှရှစ်ယောက်ကိုကိုယ်ခန္ဓာကသူတို့ကိုယ်တိုင်မဖန်တီးနိုင်ပါ၊ ၎င်းတို့ကိုအစားအစာဖြင့်ရရှိသည်။ ဤရွေ့ကား valine, leucine, isoleucine, methionine, tryptophan, lysine, threonine, phenylalanine, အသက်အဘို့အအရေးကြီးသောဖြစ်ကြသည်။
အဘယ်အရာကိုပရိုတိန်းဖြစ်ပျက်
တိရိစ္ဆာန်နှင့်ဟင်းသီးဟင်းရွက်များ (မူရင်းအလိုက်) ကိုခွဲခြားပါ။ စားသုံးမှုအမျိုးအစားနှစ်မျိုးလိုအပ်သည်။
တိရိစ္ဆာန်
ကြက်ဥအဖြူသည်ခန္ဓာကိုယ်မှအလွယ်တကူစုပ်ယူနိုင်ပြီး (၉၀-၉၂%) ။ အချဉ်ပေါက်သည့်နို့ထွက်ပစ္စည်းများ၏ပရိုတိန်းများသည် ၉၀% အထိအနည်းငယ်ပိုမိုဆိုးရွားသည်။ လတ်ဆတ်သောနို့လုံးတစ်ခုလုံး၏ပရိုတိန်းများသည် ၈၀% အထိပင်စုပ်ယူနိုင်သည်။
မရှိမဖြစ်လိုအပ်သောအမိုင်နိုအက်ဆစ်များကိုအကောင်းဆုံးပေါင်းစပ်ထားသောအမဲသားနှင့်ငါးများ၏တန်ဖိုး။
ဟင်းသီးဟင်းရွက်များ -
ပဲပုပ်၊ ကိုလာနှင့်ဝါစပါးတို့ကခန္ဓာကိုယ်အတွက်အမိုင်နိုအက်ဆစ်အချိုးကောင်းရှိသည်။ ကောက်ပဲသီးနှံများတွင်ဤအချိုးသည်အားနည်းနေသည်။
အကောင်းဆုံးသောအမိုင်နိုအက်စစ်အချိုးအစားနှင့်ထုတ်ကုန်မရှိပါ။ သင့်တင့်လျောက်ပတ်သောအစာအာဟာရသည်တိရစ္ဆာန်နှင့်ဟင်းသီးဟင်းရွက်ပရိုတင်းများပေါင်းစပ်ပါဝင်သည်။
"စည်းမျဉ်းစည်းကမ်းများအားဖြင့်" အာဟာရ၏အခြေခံတိရိစ္ဆာန်ပရိုတိန်းဖြစ်ပါတယ်။ ၎င်းသည်မရှိမဖြစ်လိုအပ်သောအမိုင်နိုအက်ဆစ်များများစားစားရှိပြီးဟင်းသီးဟင်းရွက်ပရိုတင်းကိုကောင်းစွာစုပ်ယူသည်။
ခန္ဓာကိုယ်ထဲမှာပရိုတိန်းလုပ်ဆောင်ချက်များကို
တစ်သျှူးများ၏ဆဲလ်များ၌ရှိနေခြင်းသည်လုပ်ဆောင်ချက်များစွာကိုလုပ်ဆောင်သည်။
- အကာအကွယ်။ ကိုယ်ခံစွမ်းအားစနစ်၏လည်ပတ်မှုသည်တ္ထုပစ္စည်းများကိုပျက်ဆီးစေသည်။ ပodyိပစ္စည်းထုတ်လုပ်မှုဖြစ်ပေါ်သည်။
- သယ်ယူပို့ဆောင်ရေး။ ဥပမာအားဖြင့်ဟီမိုဂလိုဘင် (အောက်စီဂျင်ထောက်ပံ့မှု) အမျိုးမျိုးသောပစ္စည်းများကိုထောက်ပံ့ပေးသည်။
- စည်းမျဉ်း။ တစ် ဦး ဟော်မုန်းနောက်ခံထိန်းသိမ်းခြင်း။
- တွန်းအား။ လှုပ်ရှားမှုအမျိုးအစားအားလုံးသည် actin နှင့် myosin ဖြစ်သည်။
- ပလပ်စတစ်။ ချိတ်ဆက်တစ်ရှူးများ၏အခြေအနေကိုကော်လာဂျင်ပါဝင်မှုဖြင့်ထိန်းချုပ်သည်။
- ဓာတ်ကူပစ္စည်း။ ၎င်းသည်ဓာတ်ကူပစ္စည်းဖြစ်ပြီးဇီဝဓာတုဆိုင်ရာတုံ့ပြန်မှုများအားအရှိန်မြှင့်တင်ပေးသည်။
- မျိုးရိုးဗီဇအချက်အလက်ထိန်းသိမ်းခြင်းနှင့်ထုတ်လွှင့်ခြင်း (DNA နှင့် RNA မော်လီကျူး) ။
- စွမ်းအင်။ ခန္ဓာကိုယ်တစ်ခုလုံးကိုစွမ်းအင်နှင့်ထောက်ပံ့မှု။
အခြားသူများကအသက်ရှုခြင်း၊ အစားအစာကိုအစာကြေစေခြင်း၊ အလင်းအာရုံခံရူဆိုင်းပရိုတိန်းသည်အမြင်အာရုံကိုတာဝန်ယူသည်။
သွေးကြောများတွင် Elastin ပါ ၀ င်ပြီး၎င်းအားအပြည့်အဝအလုပ်လုပ်သောကြောင့် fibrinogen ပရိုတိန်းသည်သွေးခဲစေပါသည်။
ခန္ဓာကိုယ်ထဲမှာပရိုတိန်းမရှိခြင်း၏ရောဂါလက္ခဏာများ
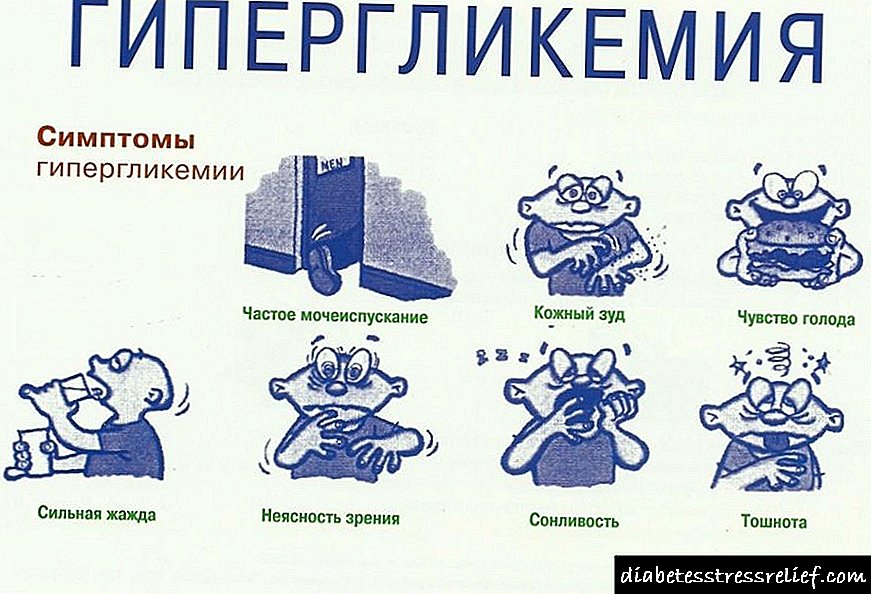
ပရိုတင်းဓာတ်ချို့တဲ့ခြင်းသည်အာဟာရချို့တဲ့မှုနှင့်ခေတ်သစ်လူတစ် ဦး ၏တုံ့ပြန်မှုများသောလူနေမှုပုံစံစသည်တို့ဖြစ်သည်။ နူးညံ့သောပုံစံဖြင့်ပုံမှန်ပင်ပန်းနွမ်းနယ်ခြင်းနှင့်စွမ်းဆောင်ရည်နိမ့်ခြင်းများကိုဖော်ပြသည်။ မလုံလောက်သောပမာဏများပြားလာခြင်းဖြင့်ခန္ဓာကိုယ်သည်ရောဂါလက္ခဏာများမှတစ်ဆင့်အချက်ပြသည် -
- အထွေထွေအားနည်းခြင်းနှင့်မူးဝြေခင်း။ စိတ်ဓာတ်နှင့်လှုပ်ရှားမှုလျော့နည်းသွားခြင်း၊ အထူးရုပ်ပိုင်းဆိုင်ရာကြိုးပမ်းအားထုတ်မှုမပါဘဲကြွက်သားပင်ပန်းနွမ်းနယ်ခြင်း၊ လှုပ်ရှားမှုညှိနှိုင်းမှုအားနည်းခြင်း၊ အာရုံစူးစိုက်မှုနှင့်မှတ်ဥာဏ်အားနည်းခြင်း။
- ခေါင်းကိုက်ခြင်းနှင့်ပိုဆိုးလာအိပ်စက်ခြင်း။ ရရှိလာတဲ့အိပ်မပျော်ခြင်းနှင့်စိုးရိမ်ပူပန်ခြင်းသည် serotonin မရှိခြင်းကိုပြသသည်။
- မကြာခဏစိတ်အပြောင်းအလဲများ, မြည်တမ်းခြင်း။ အင်ဇိုင်းများနှင့်ဟော်မုန်းများမရှိခြင်းသည် ဦး နှောက်အာရုံကြောစနစ်၏ပင်ပန်းနွမ်းနယ်မှုကိုဖြစ်စေသည်။
- အသားအရေဖျော့ဖျော့ရောင်။ သံဓာတ်ပါ ၀ င်သည့်ပရိုတင်းများမရှိခြင်းနှင့်အတူသွေးအားနည်းရောဂါဖြစ်ပေါ်လာသည်။ ရောဂါလက္ခဏာများသည်အရေပြားခြောက်သွေ့ခြင်းနှင့်ချောမွတ်ခြင်း၊ ချွဲသောအမြှေးပါးများဖြစ်သည်။
- အစွန်းရောင်ခြင်း။ ပလာစမာပရိုတိန်းပါဝင်မှုနည်းသောကြောင့်၎င်းသည်ဆားငန်ချိန်ကိုထိခိုက်စေသည်။ အရေပြားအောက်ဆုံးအဆီသည်ခြေဆစ်များနှင့်ခြေဆစ်များတွင်အရည်ကိုစုဆောင်းရရှိသည်။
- အနာနှင့်ပွန်းစားခြင်း၏ညံ့ဖျင်းသောအနာရောဂါငြိမ်းစရာ။ "ဆောက်လုပ်ရေးပစ္စည်း" မရှိခြင်းကြောင့်ဆဲလ်ပြုပြင်မှုကိုတားဆီးနိုင်သည်။
- ပျက်စီးလွယ်ခြင်းနှင့်ဆံပင်ကျွတ်ခြင်း၊ အသားအရေခြောက်သွေ့ခြင်း၊ သန္ဓေသားလောင်းချခြင်းနှင့်လက်သည်းပန်းခွံအက်ခြင်းကြောင့်ခန္ဓာကိုယ်၏ပရိုတင်းဓာတ်မလုံလောက်ခြင်းနှင့်ပတ်သက်သောအသုံးအများဆုံးအချက်ပြမှုတစ်ခုဖြစ်သည်။ ဆံပင်နှင့်လက်သည်းများအဆက်မပြတ်ကြီးထွားလာခြင်းနှင့်ကြီးထွားမှုနှင့်ကောင်းသောအခြေအနေမြှင့်တင်ရန်သောပစ္စည်းဥစ္စာများမရှိခြင်းကိုချက်ချင်းတုံ့ပြန်ကြသည်။
- ဆင်ခြင်တုံတရားမရှိသောကိုယ်အလေးချိန်ကျခြင်း မည်သည့်အကြောင်းပြချက်မှမရှိဘဲကီလိုဂရမ်ပျောက်ကွယ်သွားခြင်းသည်ခန္ဓာကိုယ်အနေဖြင့်ကြွက်သားထုကြောင့်ပရိုတင်းမရှိခြင်းကိုအစားထိုးရန်လိုအပ်ခြင်းကြောင့်ဖြစ်သည်။
- နှလုံးနှင့်သွေးကြောများ၏ချို့ယွင်းချက်, အသက်ရှူကျပ်၏ရုပ်ဆင်းသဏ္ဌာန်။ အသက်ရှူလမ်းကြောင်းဆိုင်ရာ၊ အစာခြေစနစ်နှင့်လိင်အင်္ဂါစနစ်များသည်လည်းပိုမိုဆိုးရွားလာသည်။ အူမကြီးသည်ရုပ်ပိုင်းဆိုင်ရာအားစိုက်ခြင်း၊ အအေးမိခြင်းနှင့်ဗိုင်းရပ်စ်ရောဂါများမပါဘဲပေါ်လာသည်။
ဤကဲ့သို့သောရောဂါလက္ခဏာများပေါ်ပေါက်လာပါကအစားအစာ၏အရည်အသွေးနှင့်အရည်အသွေးကိုချက်ချင်းပြောင်းလဲသင့်သည်၊ သင်၏လူနေမှုပုံစံကိုပြန်လည်စဉ်းစားသင့်သည်။
ဝါးမြိုခြင်းအတွက်ပရိုတင်းမည်မျှလိုအပ်သနည်း
တစ်နေ့စားသုံးမှုနှုန်းသည်အသက်၊ ကျား / မ၊ အလုပ်အမျိုးအစားပေါ်မူတည်သည်။ စံသတ်မှတ်ချက်များနှင့်သက်ဆိုင်သည့်အချက်အလက်များကိုဇယားတွင်ဖော်ပြထားပြီးပုံမှန်အလေးချိန်အတွက်ရည်ရွယ်သည်။
အကြိမ်ပေါင်းများစွာပရိုတိန်းစားသုံးမှုကိုနှိမ်နင်းခြင်း optional ကိုဖြစ်ပါတယ်။ တစ်ခုချင်းစီသည်မိမိအတွက်အဆင်ပြေလွယ်ကူသောပုံစံကိုဆုံးဖြတ်သည်။ အဓိကအချက်မှာနေ့စဉ်စားသုံးမှုနှုန်းကိုထိန်းသိမ်းရန်ဖြစ်သည်။
| အလုပ်သမားလှုပ်ရှားမှု + |
ရုပ်ပိုင်းဆိုင်ရာလှုပ်ရှားမှု
အစားအစာများတွင်မြင့်မားသောပရိုတိန်းပါဝင်မှု
အသိအမှတ်ပြုပရိုတင်းပါဝင်သောအစားအစာများ:
အသားအမျိုးမျိုးရှိကြက်အသားများပြီးလျှင်ပထမနေရာမှာအမဲသားဖြစ်သည်။ ၁၈.၉ ဂရမ်ပြီးနောက်ဝက်သား - ၁၆.၄ ဂရမ်၊ သိုးသငယ် - ၁၆.၂ ဂရမ်။
ပင်လယ်စာနှင့်ပြည်ကြီးငါးများသည်ခေါင်းဆောင်များဖြစ်သည်။ ၁၈.၀ ဂ။
ပရိုတိန်းအတွက်အချမ်းသာဆုံးသောငါးမှာဆော်လမွန်ဖြစ်သည်။ ၂၁.၈ ဂရမ်၊ ထို့နောက်ပန်းရောင်ဆော်လမွန် ၂၁ ဂရမ်၊ zander - ၁၉ ဂရမ်၊
နို့ထွက်ပစ္စည်းများအနက်ကီဖီနှင့်ချဉ်သောအရည်သည် ၃.၀ ဂရမ်၊ ထို့နောက်နို့ - ၂.၈ ဂရမ်ရှိသည်။
မြင့်မားသောအစေ့များ - Hercules: ၁၃.၁ ဂရမ်၊ ပြောင်းဆန် - ၁၁.၅ ဂရမ်၊
စံသတ်မှတ်ချက်ကိုသိရှိပြီးဘဏ္opportunitiesာရေးအခွင့်အလမ်းများကိုထည့်သွင်းစဉ်းစားခြင်းဖြင့်သင်သည်မီနူးတစ်ခုကိုမှန်ကန်စွာရေးသားနိုင်ပြီး၎င်းကိုအဆီနှင့်ဘိုဟိုက်ဒရိတ်များဖြင့်ဖြည့်စွက်ရန်သေချာသည်။
အာဟာရအတွက်ပရိုတိန်း၏အချိုးအစား
ကျန်းမာသောအစားအစာတွင်ပရိုတင်းများ၊ အဆီများ၊ ဘိုဟိုက်ဒရိတ်အချိုးအစား (ဂရမ်) ၁ း ၁ း ၄ ဖြစ်သင့်သည်။ ကျန်းမာသောပန်းကန်၏ဟန်ချက်ညီမှု၏သော့ကိုအခြားနည်းလမ်းဖြင့်ဖော်ပြနိုင်သည် - ပရိုတိန်း ၂၅-၃၅%၊ အဆီ ၂၅-၃၅%၊ ဘိုဟိုက်ဒရိတ် ၃၀-၅၀% ။
တစ်ချိန်တည်းမှာပင်, သံလွင်သို့မဟုတ် linseed ရေနံ, အခွံမာသီး, ငါး, ဒိန်ခဲ: အဆီအသုံးဝင်သောဖြစ်သင့်သည်။
ဟင်းသီးဟင်းရွက်အသစ်များ၊ သစ်သီးဝလံ / သစ်သီးခြောက်များ၊ နို့ထွက်ပစ္စည်းများထွက်ပေါ်လာသည်။
အချို့သောပရိုတင်းများကိုဟင်းသီးဟင်းရွက် + တိရိစ္ဆာန်များဖြင့်ပေါင်းစပ်နိုင်သည်။
ပရိုတိန်းတွင်ပါရှိသောအမိုင်နိုအက်ဆစ်များ
အပြန်အလှန်အပြန်အလှန်လဲလှယ်ခြင်းကိုခန္ဓာကိုယ်ကိုယ်တိုင်ဖန်တီးနိုင်သည်၊ သို့သော်ပြင်ပမှသူတို့၏ထောက်ပံ့မှုသည်ဘယ်သောအခါမျှမလုံလောက်ပါ။ အထူးသဖြင့်တက်ကြွသောလူနေမှုပုံစံစတဲ့၊
ခြွင်းချက်မပါဘဲအားလုံးအရေးကြီးပါတယ်, သူတို့ထဲကလူကြိုက်အများဆုံး:
Alanine ။
၎င်းသည်ဘိုဟိုက်ဒရိတ်ဇီဝြဖစ်ပျက်မှုကိုလှုံ့ဆော်ပေးပြီးအဆိပ်များကိုဖယ်ရှားပေးသည်။ "သန့်ရှင်းမှု" အတွက်တာဝန်ရှိသည်။ အသား၊ ငါး၊ နို့ထွက်ပစ္စည်းများတွင်ပါဝင်မှုမြင့်မားပါသည်။
Arginine.
ကြွက်သားများ၊ ကျန်းမာသောအသားအရေ၊ အရိုးနုနှင့်အဆစ်များကျုံ့သွားစေရန်လိုအပ်သည်။ အဆီလောင်ကျွမ်းခြင်းနှင့်ကိုယ်ခံအားစနစ်လည်ပတ်စေသည်။ ၎င်းသည်အသား၊ နို့၊ အခွံမာသီး၊
Aspartic အက်ဆစ်။
စွမ်းအင်ဟန်ချက်ကိုထောက်ပံ့ပေးသည်။ ဗဟိုအာရုံကြောစနစ်၏လုပ်ဆောင်နိုင်စွမ်းကိုတိုးတက်စေသည်။ ကောင်းပြီအမဲသားနှင့်ကြက်သားဟင်းလျာများ, နို့, ကြံသကြား၏စွမ်းအင်အရင်းအမြစ်ဖြည့်စွက်။ အာလူး, အခွံမာသီး, စီရီရယ်တွင်ပါရှိသော။
သမိုင်းကြောင်း။
ကိုယ်ခန္ဓာ၏အဓိက "တည်ဆောက်သူ" ကို histamine နှင့်ဟေမိုဂလိုဘင်အဖြစ်သို့ပြောင်းလဲပေးသည်။ ဒဏ်ရာများကိုလျှင်မြန်စွာကုသပေးသည်၊ ကြီးထွားမှုယန္တရားများအတွက်တာ ၀ န်ရှိသည်။ နို့၊ စီရီရယ်နှင့်မည်သည့်အသားများတွင်မဆိုအတော်အတန်ရှိသည်။
တိတ်ဆိတ်
ဦး နှောက်နှင့်ဗဟို ဦး နှောက်အာရုံကြောစနစ်၏ရှင်းလင်းသောလည်ပတ်မှုအတွက်မရှိမဖြစ်လိုအပ်သော Neurotransmitter ။ မြေပဲ၊ အသား၊ စီရီရယ်၊ ပဲပုပ်။
သင့်တင့်လျောက်ပတ်သောအစာအာဟာရနှင့်မှန်ကန်သောဘဝလမ်းစဉ်နှင့်အညီအမိုင်နိုအက်ဆစ်များသည်“ Cube” ၏ပေါင်းစပ်ခြင်းနှင့်ကျန်းမာရေး၊ အလှအပနှင့်အသက်ရှည်ခြင်းတို့၏မော်ဒယ်လ်အတွက်ကိုယ်ခန္ဓာထဲတွင်ပေါ်လာလိမ့်မည်။
ခန္ဓာကိုယ်ထဲမှာပရိုတိန်းမလုံလောက်မှုကိုဖြစ်စေတယ်
- မကြာခဏကူးစက်တတ်သောရောဂါများ၊ ကိုယ်ခံအားစနစ်အားနည်းခြင်း။
- စိတ်ဖိစီးမှုနှင့်စိုးရိမ်ပူပန်မှု။
- အားလုံးဇီဝဖြစ်စဉ်ဖြစ်စဉ်များ၏အိုမင်းခြင်းနှင့်နှေးကွေး။
- တစ် ဦး ချင်းဆေးဝါးများအသုံးပြုခြင်း၏ဘေးထွက်ဆိုးကျိုး။
- အစာခြေလမ်းကြောင်းအတွက်ပျက်ကွက်။
- ဒဏ်ရာများ။
- အမြန်အစားအစာ၊ ချက်ချင်းထုတ်ကုန်၊ အရည်အသွေးနိမ့်သည့် Semi- ချောထုတ်ကုန်များအပေါ် အခြေခံ၍ အစားအစာ။
တစ်ခုတည်းအမိုင်နိုအက်ဆစ်၏ချို့တဲ့တိကျတဲ့ပရိုတိန်း၏ထုတ်လုပ်မှုကိုရပ်တန့်ပါလိမ့်မယ်။ ခန္ဓာကိုယ်ကို "အချည်းနှီးသောအရာများဖြည့်ခြင်း" ၏နိယာမအရဖွဲ့စည်းထားခြင်းကြောင့်ပျောက်ဆုံးနေသောအမိုင်နိုအက်ဆစ်များကိုအခြားပရိုတင်းများမှထုတ်ယူလိမ့်မည်။ ဤ "ပြန်လည်တည်ဆောက်ခြင်း" သည်ကိုယ်တွင်းအင်္ဂါများ၊ ကြွက်သားများ၊ နှလုံး၊ ဦး နှောက်များ၏လည်ပတ်မှုကိုအနှောင့်အယှက်ပေးပြီးနောက်ပိုင်းတွင်ရောဂါကိုဖြစ်စေသည်။
ကလေးများတွင်ပရိုတင်းဓာတ်ချို့တဲ့ခြင်းသည်ကြီးထွားမှုကိုတားဆီးပေးပြီးရုပ်ပိုင်းဆိုင်ရာနှင့်စိတ်ပိုင်းဆိုင်ရာမသန်စွမ်းမှုများဖြစ်ပေါ်စေသည်။
သွေးအားနည်းရောဂါဖွံ့ဖြိုးမှု၊ အရေပြားရောဂါအသွင်အပြင်၊ အရိုးနှင့်ကြွက်သားတစ်သျှူးများရောဂါများသည်ပြည့်စုံသောရောဂါများမဟုတ်ပါ။ ပြင်းထန်သောပရိုတိန်းအလှဆင်ခြင်းကရူးသွပ်ခြင်းနှင့် Kwashiorkor ကိုဖြစ်ပေါ်စေနိုင်သည် (ပရိုတိန်းမရှိခြင်းကြောင့်ပြင်းထန်သော dystrophy အမျိုးအစား).
ပရိုတိန်းသည်ကိုယ်ခန္ဓာကိုထိခိုက်သောအခါ
- အပို reception ည့်ခံ
- အသည်း၊ ကျောက်ကပ်၊ နှလုံးနှင့်သွေးကြောများ၏နာတာရှည်ရောဂါများ။
ခန္ဓာကိုယ်မှပစ္စည်းတစ်ခုမပြည့်စုံစွာစုပ်ယူမှုကြောင့်အလွန်အကျွံဖြည့်တင်းခြင်းသည်မကြာခဏဖြစ်လေ့မရှိပါ။လေ့ကျင့်သူနှင့်အာဟာရပညာရှင်များ၏အကြံပြုချက်များကိုမလိုက်နာဘဲကြွက်သားများကိုတတ်နိုင်သမျှအမြန်ဆုံးမြှင့်တင်လိုသူများတွင်ဖြစ်ပွားသည်။
"ပိုလျှံ" reception ည့်ခံ၏ပြproblemsနာများပါဝင်သည်
ကျောက်ကပ်ဆိုင်ရာပျက်ကွက်။ အလွန်အကျွံပမာဏသည်ပရိုတိန်းအလွန်အကျွံသယ်ဆောင်သောကိုယ်တွင်းအင်္ဂါများနှင့်သူတို့၏သဘာဝလုပ်ဆောင်မှုကိုပျက်ပြားစေသည်။ "Filter" ဝန်နှင့်အတူရင်ဆိုင်ဖြေရှင်းနိုင်မနိုင်, ကျောက်ကပ်ရောဂါပေါ်လာသည်။
အသည်းရောဂါ။ ပိုလျှံသောပရိုတိန်းသည်အသည်း၏အခြေအနေကိုပိုမိုဆိုးဝါးစေသောသွေးထဲတွင်အမိုးနီးယားကိုစုဆောင်းသည်။
atherosclerosis ၏ဖွံ့ဖြိုးတိုးတက်မှု။ အသုံးဝင်သောအရာများအပြင်တိရိစ္ဆာန်ထုတ်ကုန်အများစုတွင်အန္တရာယ်ရှိသောအဆီနှင့်ကိုလက်စထရောပါဝင်သည်။
အသည်း၊ ကျောက်ကပ်၊ နှလုံးသွေးကြောဆိုင်ရာနှင့်အစာခြေစနစ်များရောဂါခံစားနေရသောလူများသည်ပရိုတိန်းများစားသုံးမှုကိုကန့်သတ်သင့်သည်။
မိမိတို့၏ကျန်းမာရေးကိုဂရုစိုက်ခြင်းသည်စိုးရိမ်ပူပန်နေသူများအတွက်အကျိုးထူးသည်။ ဆိုးရွားသည့်အကျိုးဆက်များကိုရှောင်ရှားရန်အတွက်သင်ပြန်လည်ထူထောင်ရန်အတွက်ခန္ဓာကိုယ်၏လိုအပ်ချက်ကိုသတိရရန်လိုအပ်သည်။ အပြည့်အဝအနားယူခြင်း၊ အာဟာရရှိခြင်း၊ လာရောက်လည်ပတ်သည့်အထူးကုများသည်လူငယ်များ၊ ကျန်းမာရေးနှင့်ဘဝများကိုရှည်စေသည်။
ပျော်ဝင်နိုင်ခြင်း
ပရိုတင်းများသည်ရေတွင်ပျော်ဝင်နိုင်မှုအဆင့်နှင့်ခြားနားသည်။ ရေတွင်ပျော်ဝင်နိုင်သောပရိုတင်းများကိုအယ်လ်ဗျူမင်ဟုခေါ်သည်။ ၎င်းတွင်သွေးနှင့်နို့ပရိုတင်းများပါဝင်သည်။ ပျော်ဝင်နိုင်ခြင်းမရှိသောနဗ်ကြောပရိုတိန်းများတွင်ဥပမာအားဖြင့်ပိုးနှင့်ပင့်ကူအိမ်၏အစိတ်အပိုင်းဖြစ်သော fibroin တွင် keratin (ဆံပင်ကိုဖွဲ့စည်းထားသောပရိုတင်း၊ နို့တိုက်သတ္တဝါများ၏ဆံပင်၊ ငှက်မွှေးများ) နှင့် fibroin တို့ပါ ၀ င်သည်။ ပရိုတိန်း၏ပျော်ဝင်နိုင်မှုကို၎င်း၏ဖွဲ့စည်းပုံအားဖြင့်သာမကအရည်ပျော်ပစ္စည်း၏သဘောသဘာဝ၊ အိုင်းယွန်းအင်အားနှင့်ဖြေရှင်းချက်၏ pH ကဲ့သို့သောပြင်ပအချက်များကဆုံးဖြတ်သည်။
ပရိုတိန်းများကို hydrophilic (ရေတွင်ပျော်ဝင်နိုင်သော) နှင့် hydrophobic (water-repellent) အဖြစ်ခွဲခြားထားသည်။ ပျော်ဝင်နိုင်သည့် keratin နှင့် fibroin အပါအဝင် cytoplasm, nucleus နှင့် intercellular ပစ္စည်းများ၏ပရိုတိန်းအများစုသည် hydrophilic ဖြစ်သည်။ ဇီဝအလွှာများဖြင့်ဖွဲ့စည်းထားသောပရိုတိန်းအများစုသည် hydrophobic - အမြှေးပါး၏ hydrophobic lipids (အများအားဖြင့် hydrophilic sites) များနှင့်အပြန်အလှန်ဆက်သွယ်သည့်အမြှေးပါးအမြှေးပါးပရိုတိန်းများဖြစ်သည်။
ခန္ဓာကိုယ်ထဲမှာပရိုတိန်း biosynthesis
ပရိုတိန်း biosynthesis - အမိုင်နိုအက်ဆစ်များမှအလိုရှိသောပရိုတိန်း၏ခန္ဓာကိုယ်ထဲတွင် polypeptide ကွင်းဆက် - အထူးဓာတုနှောင်ကြိုးနှင့်ပေါင်းစပ်ခြင်းဖြင့်ဖွဲ့စည်းသည်။ ဒီအင်အေသည်ပရိုတိန်းဖွဲ့စည်းပုံနှင့်ပတ်သက်သည့်အချက်အလက်များကိုသိုလှောင်ထားသည်။ ပေါင်းစပ်ခြင်းကိုသူ့ဟာသူဆဲလ်၏အထူးအစိတ်အပိုင်းတစ်ခုတွင်ရိုင်ဗိုဇုမ်းဟုခေါ်သည်။ RNA သည်လိုချင်သောဗီဇ (DNA site) မှသတင်းအချက်အလက်များကိုရိုင်ဗိုဇုမ်းသို့လွှဲပြောင်းပေးသည်။
ပရိုတိန်း biosynthesis သည်အဆင့်များစွာရှိပြီးရှုပ်ထွေးပြီး၎င်းသည်လူ့ဖြစ်တည်မှုအခြေခံ - ဒီအင်အေတွင်ဖော်ပြထားသောသတင်းအချက်အလက်ကိုအသုံးပြုသည်။ ၎င်း၏ဓာတုဗေဒဆိုင်ရာပေါင်းစပ်မှုသည်ခက်ခဲသောလုပ်ငန်းတာဝန်တစ်ခုဖြစ်သည်။ သိပ္ပံပညာရှင်များသည်အချို့သောအင်ဇိုင်းများနှင့်ဟော်မုန်းများ၏တားစီးမှုကိုရရှိရန်မည်သို့လေ့လာရမည်ကိုလေ့လာခဲ့ကြသော်လည်းအရေးကြီးဆုံးသိပ္ပံနည်းကျလုပ်ငန်းမှာမျိုးရိုးဗီဇဆိုင်ရာအင်ဂျင်နီယာကို အသုံးပြု၍ ပရိုတိန်းများရရှိရန်ဖြစ်သည်။

သယ်ယူပို့ဆောင်ရေး
ဟေမိုဂလိုဘင် - အထူးသွေးပရိုတင်းတစ်ခု၏သယ်ယူပို့ဆောင်ရေး function ကို။ ဒီပရိုတိန်းကြောင့်အဆုတ်မှခန္ဓာကိုယ်၏အင်္ဂါများနှင့်တစ်သျှူးများသို့အောက်စီဂျင်ကိုပို့ပေးတယ်။
၎င်းသည် antibodies ဟုခေါ်သောကိုယ်ခံအားစနစ်၏ပရိုတိန်းများ၏လုပ်ဆောင်မှုတွင်ပါဝင်သည်။ ၎င်းသည်ခန္ဓာကိုယ်၏ကျန်းမာရေးကိုကာကွယ်ပေးသည်၊ ၎င်းကိုဘက်တီးရီးယား၊ ဗိုင်းရပ်စ်များ၊ အဆိပ်များမှကာကွယ်ပေးပြီးပွင့်လင်းသောအနာအစားသွေးခဲစေနိုင်သည်။
ပရိုတိန်း၏အချက်ပြမှုသည်ဆဲလ်များအကြားရှိအချက်အလက်များ (သတင်းအချက်အလက်) ကိုထုတ်လွှင့်ရန်ဖြစ်သည်။
လူကြီးများအတွက်ပရိုတိန်းစံနှုန်းများ
လူ့ခန္ဓာကိုယ်၏ပရိုတိန်းလိုအပ်မှုသည်၎င်း၏ရုပ်ပိုင်းဆိုင်ရာလုပ်ဆောင်မှုပေါ်တွင်မူတည်သည်။ ငါတို့လှုပ်ရှားလေလေဇီဝဓါတုဗေဒဆိုင်ရာတုံ့ပြန်မှုများအားလုံးသည်ကျွန်ုပ်တို့၏ကိုယ်ခန္ဓာတွင်ပိုမိုလျင်မြန်လေလေဖြစ်သည်။ ပုံမှန်လေ့ကျင့်ခန်းလုပ်သူများသည်သာမန်လူတစ်ယောက်ထက်ပရိုတင်းဓာတ်နှစ်ဆနီးပါးပိုလိုအပ်သည်။ အားကစားတွင်ပါဝင်သူများအတွက်ပရိုတိန်းမရှိခြင်းသည်ကြွက်သားများခြောက်သွေ့ခြင်းနှင့်ကိုယ်ခန္ဓာတစ်ခုလုံး၏ပင်ပန်းနွမ်းနယ်မှုကိုအန္တရာယ်ဖြစ်စေသည်။
ပျမ်းမျှအားဖြင့်အရွယ်ရောက်ပြီးသူများအတွက်ပရိုတင်းပမာဏကို ၁ ကီလိုဂရမ်အလေးချိန် ၁ ကီလိုဂရမ်ပရိုတိန်း၏ကိန်းဂဏန်းအရတွက်ချက်သည်။ အမျိုးသားများအတွက်ခန့်မှန်းခြေအားဖြင့် ၈၀-၁၀၀ ဂရမ်၊ အမျိုးသမီးများအတွက် ၅၅-၆၀ ဂရမ်။ အမျိုးသားအားကစားသမားများသည်တစ်နေ့လျှင် ၁၇၀ မှ ၂၀၀ ဂရမ်အထိစားသုံးသည့်ပရိုတင်းပမာဏကိုတိုးမြှင့်ပေးရန်အကြံပြုသည်။

ခန္ဓာကိုယ်အတွက်သင့်လျော်သောပရိုတိန်းအစာအာဟာရ
ခန္ဓာကိုယ်ကိုပရိုတိန်းများနှင့်ပြည့်နှက်စေရန်သင့်တော်သောအာဟာရသည်တိရိစ္ဆာန်နှင့်အပင်ပရိုတင်းဓာတ်ပေါင်းစပ်ထားခြင်းဖြစ်သည်။ အစားအစာမှပရိုတိန်း၏သဘာ ၀ အတိုင်းအတာသည်၎င်း၏မူလအစနှင့်အပူကုသမှုနည်းလမ်းပေါ်တွင်မူတည်သည်။
ထို့ကြောင့်တိရိစ္ဆာန်ပရိုတိန်းစုစုပေါင်းစားသုံးမှု၏ ၈၀% နှင့်ဟင်းသီးဟင်းရွက်ပရိုတင်း ၆၀% သည်ခန္ဓာကိုယ်မှစုပ်ယူသည်။ တိရိစ္ဆာန်မှထွက်ရှိသည့်ထုတ်ကုန်များသည်ဟင်းသီးဟင်းရွက်ထက်ထုတ်ကုန်တစ်ယူနစ်တွင်ပရိုတင်းပမာဏများစွာပါ ၀ င်သည်။ ထို့အပြင် "တိရိစ္ဆာန်" ထုတ်ကုန်များဖွဲ့စည်းမှုတွင်အမိုင်နိုအက်ဆစ်များပါ ၀ င်ပြီးအပင်မှထုတ်ကုန်များသည်လည်းယုတ်ညံ့သည်ဟုယူဆကြသည်။
ပိုမိုကောင်းမွန်သောပရိုတင်းဓာတ်စုပ်ယူမှုအတွက်အခြေခံအာဟာရစည်းမျဉ်းများ -
- ချက်ပြုတ်ခြင်း၊ steaming လုပ်ခြင်း၊ ကြော်ခြင်းကိုပယ်ဖျက်သင့်သည်။
- ငါးများနှင့်ကြက်များပိုမိုစားရန်အကြံပြုသည်။ သင်အမဲသားကိုတကယ်လိုချင်လျှင်အမဲသားကိုရွေးချယ်ပါ။
- ဟင်းသီးဟင်းရွက်များကိုအစားအစာမှဖယ်ထုတ်သင့်သည်၊ ပြင်းထန်သောဖြစ်ရပ်များတွင်၊ သင်သည်ဒုတိယဟင်းရည်ကို အသုံးပြု၍ ပထမဆုံးပန်းကန်ကိုချက်ပြုတ်နိုင်သည်။
ကြွက်သားကြီးထွားမှုအတွက်ပရိုတိန်းအာဟာရ၏အင်္ဂါရပ်များ
ကြွက်သားထုထည်တက်ကြွစွာတက်ကြွနေသောအားကစားသမားများသည်အထက်ပါအကြံပြုချက်များအားလုံးကိုလိုက်နာသင့်သည်။ သူတို့၏အစားအစာအများစုသည်တိရိစ္ဆာန်များမှပရိုတင်းများဖြစ်သင့်သည်။ ၎င်းတို့ကိုဟင်းသီးဟင်းရွက်ပရိုတိန်းထုတ်ကုန်များနှင့်တွဲဖက်စားသုံးသင့်သည်။
ဆရာ ၀ န်တစ် ဦး နှင့်တိုင်ပင်ပြီးအထူးပရိုတင်းဓာတ်အချိုရည်များအသုံးပြုမှုကိုစဉ်းစားရန်လိုအပ်သည်။ ၎င်းသည်ပရိုတိန်းစုပ်ယူမှုရာခိုင်နှုန်း၏ ၉၇ မှ ၉၈ ရာခိုင်နှုန်းဖြစ်သည်။ အဆိုပါအထူးကုတစ် ဦး ချင်းစီသောက်ရွေး, မှန်ကန်သောသောက်သုံးသောတွက်ချက်ပါလိမ့်မယ်။ ၎င်းသည်အားကောင်းသောလေ့ကျင့်မှုအတွက်သာယာသောနှင့်အသုံးဝင်သောပရိုတိန်းဖြည့်စွက်မှုဖြစ်လိမ့်မည်။
Denaturation
Protein denaturation သည် ၄ င်း၏ဇီဝဗေဒဆိုင်ရာလှုပ်ရှားမှုနှင့် / သို့မဟုတ်လေးပုံတပုံ၊ တတိယအဆင့်သို့မဟုတ်အလယ်တည့်ဖွဲ့စည်းမှုများဆုံးရှုံးမှုနှင့်ဆက်စပ်သည့်ရူပဗေဒဓာတုဗေဒဆိုင်ရာပြောင်းလဲမှုများကိုရည်ညွှန်းသည် (အပိုင်း "ပရိုတိန်းဖွဲ့စည်းပုံ" ကိုကြည့်ပါ) ။ စည်းကမ်းများအရပရိုတိန်းများသည်ပုံမှန်အားဖြင့်ခန္ဓာကိုယ်အတွင်း၌အလုပ်လုပ်သောအခြေအနေများ (အပူချိန်၊ pH၊ စသည်တို့) တွင်တည်ငြိမ်သည်။ ဤအခြေအနေများတွင်သိသိသာသာပြောင်းလဲခြင်းသည်ပရိုတင်းဓာတ်ကိုကျဆင်းစေနိုင်သည်။ အဆိုပါ denaturing အေးဂျင့်များ၏သဘောသဘာဝအပေါ်မူတည်ပြီးစက်မှု (ပြင်းထန်သောတုန်ခါသို့မဟုတ်လှုပ်), ရုပ်ပိုင်းဆိုင်ရာ (အပူ, အအေး, irradiation, sonication) နှင့်ဓာတု (အက်ဆစ်နှင့်အယ်ကာလီ, surfactants, ယူရီးယား) denaturation ခွဲခြားထားပါသည်။
ပရိုတိန်းကန့်သတ်ချက်သည်ပြည့်စုံခြင်း၊ တစ်စိတ်တစ်ပိုင်းဖြစ်စေ၊ ပြောင်းပြန်ဖြစ်စေ၊ နေ့စဉ်အသက်တာ၌မပြောင်းလဲနိုင်သောပရိုတိန်း denaturation ၏အကျော်ကြားဆုံးဖြစ်ရပ်မှာအပူချိန်မြင့်မားမှုကြောင့်ရေတွင်ပျော်ဝင်နေသောပွင့်လင်းသောပရိုတင်းဓာတ် ovalbumin သည်သိပ်သည်း၊ မပျော်ဝင်နိုင်၊ ရေတွင်ပျော်ဝင်နေသောပရိုတင်းများသည် ammonium salts (salting out method) ကို အသုံးပြု၍ မိုးရွာသွန်းမှုဖြစ်သကဲ့သို့အချို့သောအခြေအနေများတွင် denaturation သည်ပြောင်းပြန်ဖြစ်သွားပြီး၎င်းကို၎င်းကိုသန့်ရှင်းစေရန်နည်းလမ်းတစ်ခုအဖြစ်အသုံးပြုသည်။
ပရိုတိန်းမော်လီကျူးများသည် linear polymers များဖြစ်ပြီးα-L-amino acids (monomers များ) နှင့်လည်းပြုပြင်ထားသောအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များနှင့်အမိုင်နိုအက်ဆစ်မဟုတ်သောသဘာဝ၏အစိတ်အပိုင်းများကိုပရိုတိန်းများဖွဲ့စည်းနိုင်သည်။ သိပ္ပံနည်းကျစာပေများတွင်အမိုင်နိုအက်ဆစ်များကိုရည်ညွှန်းရာတွင်သုံးလုံးသို့မဟုတ်သုံးအက္ခရာအတိုကောက်ကိုအသုံးပြုသည်။ ပထမတစ်ချက်မှာပရိုတိန်းအများစုတွင် "သာ" အမိုင်နိုအက်ဆစ်အမျိုးအစား ၂၀ ကိုအသုံးပြုခြင်းသည်ပရိုတင်းဖွဲ့စည်းပုံ၏မတူကွဲပြားမှုကိုကန့်သတ်ထားသည်ဟုထင်ရသော်လည်းရွေးချယ်စရာများအရေအတွက်သည်အလွန်အမင်းခန့်မှန်းရခက်နိုင်သည်။ (သေးငယ်သောပရိုတိန်း) ကို ၁၀၁၃၀ မျိုးကွဲများတွင်ကိုယ်စားပြုနိုင်သည်။ 2 မှသောင်းချီသောအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များမှပရိုတိန်းများကိုမကြာခဏခေါ်လေ့ရှိသည် peptidesပိုလီမာဆေးပိုလီမာမှုပိုများလာပြီး ရှဥ့်ဒီဌာနခွဲကအရမ်းမတရားပေမယ့်။
ပရိုတိန်းα-amino group (-NH) နှင့်အမိုင်နိုအက်ဆစ်တစ်ခု၏α-carboxyl အုပ်စု (-COOH) ၏အပြန်အလှန်အကျိုးသက်ရောက်မှုကြောင့်ဖြစ်ပေါ်လာသောအခါ2) အခြားအမိုင်နိုအက်ဆစ်၏, peptide ခံရသောချည်နှောင်ခြင်းကြောင့်ဖွဲ့စည်းထားပါသည်။ ပရိုတိန်း၏အဆုံးများကိုအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်၏မည်သည့်အုပ်စုများပေါ် မူတည်၍ N- နှင့် C-terminus ဟုခေါ်သည် - -NH2 အသီးသီးသို့မဟုတ် -COOH ။ ရိုင်ဗိုဇုမ်းရောဂါအပေါ်ပရိုတိန်းပေါင်းစပ်မှုတွင်ပထမ (N-terminal) အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များသည်များသောအားဖြင့်မက်မီနီယမ်အကြွင်းအကျန်ဖြစ်ပြီးနောက်ဆက်တွဲအကြွင်းအကျန်များကိုယခင်အရာ၏စီဂရပ်စ်နှင့်တွဲထားသည်။
ပရိုတိန်းအာဟာရ၏အင်္ဂါရပ်များ, အစားအသောက်
ကိုယ်အလေးချိန်လျှော့ချလိုသူများသည်တိရိစ္ဆာန်နှင့်ဟင်းသီးဟင်းရွက်ပရိုတိန်းထုတ်ကုန်များကိုစားသုံးသင့်သည်။ ၄ င်းတို့၏စားသုံးမှုကိုခွဲခြားရန်အရေးကြီးသည်။ အဆီအသားထုတ်ကုန်များကိုစွန့်ပစ်သင့်သည်၊ အာလူးကိုအလွဲသုံးစားမပြုသင့်ပါ၊
အစွန်းရောက်သွားခြင်းနှင့်ပရိုတိန်းဓာတ်စာကိုမထိုင်ပါနှင့်။ ဘာကြောင့်လဲဆိုတော့ဘိုဟိုက်ဒရိတ်တွေကိုလုံးဝဖယ်ထုတ်လိုက်တာကအလုပ်လုပ်နိုင်စွမ်းနဲ့စွမ်းအင်ကိုကျဆင်းစေတယ်။ နံနက်ခင်း၌ဘိုဟိုက်ဒရိတ်ပါဝင်သောအစားအစာများကိုစားရန်လုံလောက်သည် - နေ့အချိန်တွင်စွမ်းအင်ပေးသည်၊ နေ့လည်ခင်းတွင်ပရိုတင်းဓာတ်နည်းသောအစာကိုစားနိုင်သည်။ ညနေခင်းတွင်စွမ်းအင်ပြတ်လပ်မှုကိုဖြေရှင်းရန်ကိုယ်ခန္ဓာသည်အဆီကိုစတင်လောင်ကျွမ်းလိမ့်မည်၊ သို့သော်၎င်းဖြစ်စဉ်သည်ကိုယ်ခန္ဓာ၏ကျန်းမာရေးအတွက်လုံခြုံသည်။
သင့်အစားအစာတွင်မှန်ကန်သော၊ မှန်ကန်စွာပြင်ဆင်ထားသောပရိုတိန်းအစာများပါ ၀ င်ပါစေ။ ကိုယ်ခန္ဓာအတွက်ပရိုတိန်းသည်အဓိကဆောက်လုပ်ရေးပစ္စည်းဖြစ်သည်။ ပုံမှန်လေ့ကျင့်ခြင်းနှင့်အတူ၎င်းသည်သင့်အားလှပသောအားကစားကိုယ်ခန္ဓာတည်ဆောက်ရန်ကူညီလိမ့်မည်။
ပရိုတင်းများသည်အရေးအပါဆုံးဓာတုဒြပ်ပေါင်းများဖြစ်သည်။ ပရိုတင်းများသည်အင်ဇိုင်းများ၊ ကိုယ်တွင်းအင်္ဂါဆဲလ်များ၊ တစ်ရှူးများဖြစ်သည်။ ၎င်းတို့သည်ဇီဝဖြစ်စဉ်၊ သယ်ယူပို့ဆောင်ရေးနှင့်လူ့ခန္ဓာကိုယ်အတွင်းဖြစ်ပျက်နေသောအခြားဖြစ်စဉ်များအတွက်တာဝန်ရှိသည်။ ပရိုတိန်းများသည်“ သိုလှောင်ခြင်း” တွင်စုဆောင်း။ မရပါ၊ ထို့ကြောင့်သူတို့ကိုပုံမှန်စားသုံးရန်လိုအပ်သည်။ ၎င်းတို့သည်အားကစားတွင်ပါဝင်သူများအတွက်အထူးအရေးပါသည်၊ အဘယ့်ကြောင့်ဆိုသော်ပရိုတိန်းများကိုစည်းမျဉ်းသတ်မှတ်ထားသောကြောင့်ဖြစ်သည်။
ဖွဲ့စည်းပုံအဆင့်များ

K. Lindstrom-Lang သည်ပရိုတိန်းဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာအဆင့် ၄ ဆင့်ကိုခွဲခြားရန်အဆိုပြုထားသည်။ မူလတန်း၊ အလယ်တန်း၊ တတိယနှင့်စတုတ္ထအဆင့်များ။ ဤဌာနခွဲသည်ခေတ်နောက်ကျသော်လည်း၎င်းကိုဆက်လက်အသုံးပြုနေသည်။ polypeptide ၏မူလဖွဲ့စည်းတည်ဆောက်ပုံ (အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များ) ကို၎င်း၏မျိုးရိုးဗီဇနှင့်မျိုးရိုးဗီဇကုဒ်၏ဖွဲ့စည်းပုံကဆုံးဖြတ်သည်။ အဆင့်မြင့်အမိန့်များဖွဲ့စည်းပုံကိုပရိုတိန်းခေါက်ခြင်းလုပ်ငန်းစဉ်တွင်ဖွဲ့စည်းသည်။ ပရိုတိန်းတစ်ခုလုံး၏ Spatial ဖွဲ့စည်းပုံကိုအမိုင်နိုအက်ဆစ်အစီအစဉ်အရဆုံးဖြတ်သော်လည်း၎င်းသည်ပြင်ပအခြေအနေများအပေါ်တွင်မူတည်သည်။ ထို့ကြောင့်၎င်းသည် ဦး စားပေးသို့မဟုတ်စွမ်းအင်အရအရှိဆုံးပရိုတိန်းဖွဲ့စည်းမှုအကြောင်းပြောဆိုခြင်းသည် ပို၍ မှန်ကန်သည်။
မူလတန်းဖွဲ့စည်းပုံ

အဓိကဖွဲ့စည်းပုံမှာ polypeptide ကွင်းဆက်တွင်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များဖြစ်သည်။ ပရိုတိန်း၏မူလဖွဲ့စည်းပုံကိုအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များအတွက်တစ်ခုတည်းသို့မဟုတ်သုံးအက္ခရာသင်္ကေတများ အသုံးပြု၍ ဖော်ပြလေ့ရှိသည်။
အဓိကဖွဲ့စည်းတည်ဆောက်ပုံ၏အရေးကြီးသောအင်္ဂါရပ်များမှာရှေးရိုးစွဲပုံစံများဖြစ်သည် - အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များ၏တည်ငြိမ်သောပေါင်းစပ်မှုတစ်ခုသည်လုပ်ဆောင်မှုအချို့ကိုလုပ်ဆောင်ပြီးပရိုတိန်းများစွာတွင်တွေ့ရသည်။ ရှေးရိုးအစဉ်အလာများကိုမျိုးစိတ်ဆင့်ကဲပြောင်းလဲစဉ်ကာလအတွင်းထိန်းသိမ်းထားပြီး ၄ င်းတို့မှမသိသောပရိုတိန်း၏လုပ်ဆောင်မှုကိုကြိုတင်ခန့်မှန်းနိုင်သည်။ ကွဲပြားခြားနားသောသက်ရှိများ၏ပရိုတိန်း၏အမိုင်နိုအက်ဆစ်ပာ၏ homology (တူညီမှု) ၏ဒီဂရီသည်ဤသက်ရှိများနှင့်သက်ဆိုင်သော taxa များအကြားဆင့်ကဲဖြစ်စဉ်အကွာအဝေးကိုအကဲဖြတ်ရန်အသုံးပြုနိုင်သည်။
ပရိုတိန်း၏မူလဖွဲ့စည်းတည်ဆောက်ပုံကိုပရိုတိန်းအစီအစဉ်နည်းလမ်းများသို့မဟုတ်မျိုးရိုးဗီဇကုဒ်ဇယားကိုအသုံးပြုပြီး၎င်း၏ mRNA ၏ဖွဲ့စည်းပုံကဆုံးဖြတ်နိုင်သည်။
အလယ်တန်းဖွဲ့စည်းပုံ
အလယ်အလတ်ဖွဲ့စည်းပုံသည်ဟိုက်ဒရိုဂျင်ဘွန်းများဖြင့်တည်ငြိမ်စေသောပိုလီပက်ထရိတ်ကွင်းဆက်၏အပိုင်းအစတစ်ခုအားဒေသဆိုင်ရာအမိန့်ပေးခြင်းဖြစ်သည်။အောက်ပါတို့သည်ဒုတိယပရိုတင်းဖွဲ့စည်းတည်ဆောက်ပုံအမျိုးအစားများဖြစ်သည်။
- α-helices များသည်မော်လီကျူး၏ရှည်လျားသောဝင်ရိုးပတ်လည်တွင်သိပ်သည်းသောအလှည့်အပြောင်းများဖြစ်သည်။ အလှည့်တစ်ခုမှာ ၃.၆ အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များ၊ helix အစေးသည် ၀.၅၄ nm (၀.၁၅ nm အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်အပေါ်) ။ အဆိုပါလိမ် H နှင့် O peptide အုပ်စုများအကြားဟိုက်ဒရိုဂျင်ခံရသောချည်နှောင်ခြင်းကြောင့်တည်ငြိမ်နေသည် 4 ယူနစ်ဆိတ်ကွယ်ရာ။ α-helix သည်လက်ဝဲသို့မဟုတ်လက်ယာဖြစ်စေဖြစ်သော်လည်းပရိုတိန်းတွင်လက်ယာလက်များသည်အဓိကကျသည်။ glutamic acid, lysine, arginine တို့၏ electrostatic interaction ကလည်မျောလိမ်အားပျက်စီးစေသည်။ တစ် ဦး နှင့်တစ် ဦး နီးကပ်စွာ၊ asparagine, serine, threonine နှင့် leucine အကြွင်းအကျန်များသည် helix ၏ဖွဲ့စည်းမှုကိုအဟန့်အတားဖြစ်စေနိုင်သည်၊ proline အကြွင်းအကျန်များသည်ကွင်းဆက်ကွေးခြင်းနှင့်α-helices များကိုအနှောက်အယှက်ဖြစ်စေနိုင်သည်။
- β-sheets (ခေါက်အလွှာများ) သည် zigzag polypeptide chains များဖြစ်သည်။ ဟိုက်ဒရိုဂျင်နှောင်ကြိုးများသည်တစ်ခုနှင့်တစ်ခုအကြားဝေးလံသောနေရာတွင် (အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်နှုန်း ၀.၃၄ nm) အမိုင်နိုအက်ဆစ်များ (သို့) ကွဲပြားခြားနားသောပရိုတိန်းချည်နှောင်မှုတွင်ဖြစ်ပေါ်သည်။ ) အα-helix အတွက်ဖြစ်လိမ့်မည်။ ဤရွေ့ကားချည်နှောင်ခြင်းကိုများသောအားဖြင့်ဆန့်ကျင်ဘက် (antiparallel orientation) သို့မဟုတ်တလမ်းတည်း (အပြိုင်β-ဖွဲ့စည်းပုံ) တွင် N-end ဖြင့်ညွှန်ကြားလေ့ရှိသည်။ ဒါဟာအပြိုင်နှင့် antiparallel β-အဆောက်အ ဦ များပါဝင်သည်ဟုတစ် ဦး ရောနှောβ-ဖွဲ့စည်းပုံ၏တည်ရှိမှုကိုလည်းဖြစ်နိုင်ပါတယ်။ β-sheets များဖွဲ့စည်းခြင်းအတွက်အမိုင်နိုအက်ဆစ်များ၏ဘေးထွက်အုပ်စုငယ်များသည်အရေးကြီးသည်။ များသောအားဖြင့် glycine နှင့် alanine predominate, t
- π-helix
- 310လိမ်
- unordered အပိုင်းအစများ။
တတိယအဆင့်ဖွဲ့စည်းပုံ

အဆိုပါတတိယအဆင့်ဖွဲ့စည်းပုံဟာ polypeptide ကွင်းဆက်၏ Spatial ဖွဲ့စည်းပုံဖြစ်ပါတယ်။ ဖွဲ့စည်းတည်ဆောက်ပုံအရ၎င်းသည် hydrophobic interaction ကအလွန်အရေးကြီးသောအခန်းကဏ္whichတွင်ပါဝင်သောအမျိုးမျိုးသောအပြန်အလှန်အားဖြင့်တည်ငြိမ်သောအလယ်အလတ်ဖွဲ့စည်းပုံ၏ဒြပ်စင်များဖြစ်သည်။ အဆိုပါတက္ကသိုလ်ဖွဲ့စည်းပုံ၏တည်ငြိမ်ပါဝင်သည်:
- covalent bond (cysteine အကြွင်းအကျန်နှစ်ခု - disulfide bridges အကြား)၊
- ဆန့်ကျင်ဘက်အားဖြင့်တရားစွဲဆိုဘက်ခြမ်းအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်အကြား ionic ခံရသောချည်နှောင်ခြင်းကြောင့်,
- ဟိုက်ဒရိုဂျင်နှောင်ကြိုး
- hydrophobic interaction က။ ပတ်ဝန်းကျင်ရေမော်လီကျူးများနှင့်အပြန်အလှန်ဆက်သွယ်သောအခါပရိုတိန်းမော်လီကျူးသည်အမိုင်နိုအက်ဆစ်များ၏ nonpolar ဘေးထွက်အုပ်စုများကိုရေပျော်ရည်မှသီးခြားခွဲထုတ်။ polar hydrophilic ဘေးထွက်အုပ်စုများသည်မော်လီကျူး၏မျက်နှာပြင်ပေါ်တွင်ပေါ်လာသည်။
ပရိုတိန်းခေါက်ထားခြင်း၏နိယာမများကိုလေ့လာခြင်းသည်ဒုတိယဖွဲ့စည်းပုံနှင့်အက်တမ် Spatial ဖွဲ့စည်းပုံ၏အဆင့်ကို - ခေါက်သော motif (ဗိသုကာ၊ ဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာ) - ခွဲခြားရန်အဆင်ပြေကြောင်းပြသခဲ့သည်။ ပုံစံပုံစံကိုပရိုတိန်းဒိုမိန်းအတွင်းရှိα-helices နှင့်β-strands ၏အလယ်တည့်ဖွဲ့စည်းမှုဒြပ်စင်များ၏အပြန်အလှန်စီစဉ်ခြင်းဖြင့်ဆုံးဖြတ်သည်။ ၎င်းသည်သူ့ဟာသူတည်ရှိနိုင်သည်သို့မဟုတ်အခြားသောဒိုမိန်းများနှင့်အတူပိုကြီးသည့်ပရိုတိန်း၏အစိတ်အပိုင်းတစ်ခုဖြစ်နိုင်သည်။ ဥပမာအားဖြင့်ပရိုတိန်းဖွဲ့စည်းပုံ၏ထူးခြားသောလက္ခဏာတစ်ခုဖြစ်သည်။ လက်ျာဘက်ပုံတွင်ပြထားသော globular protein သည် triosophosphatisomerase တွင်α / β-cylinder ဟုခေါ်သောခေါက် motif တစ်ခုရှိသည်။ ၈ အပြိုင်β-strands သည် ၈ α-helices ဖြင့်ဖွဲ့စည်းထားသောအခြားဆလင်ဒါတစ်ခုအတွင်းβ-cylinder ကိုဖွဲ့စည်းသည်။ ဤသည် motif ပရိုတိန်း၏ 10% မှာတွေ့ရှိရပါသည်။
ပုံစံပုံစံများသည်အတော်အတန်ရှေးရိုးစွဲများဖြစ်ပြီးအလုပ်လုပ်မှုရောဆင့်ကဲပြောင်းလဲမှုဆိုင်ရာဆက်နွယ်မှုမရှိသောပရိုတိန်းများတွင်တွေ့ရသည်ဟုလူသိများသည်။ ပုံစံစိတ်ရင်း၏ဆုံးဖြတ်ချက် (ထိုကဲ့သို့သော CATH သို့မဟုတ် SCOP ကဲ့သို့) ပရိုတိန်း၏ရုပ်ပိုင်းဆိုင်ရာ, ဒါမှမဟုတ်ဆင်ခြင်တုံတရားခွဲခြားအခြေခံပါတယ်။
ပရိုတိန်း၏ Spatial ဖွဲ့စည်းပုံကိုဆုံးဖြတ်ရန် x-Ray diffraction analysis၊ နျူကလီးယားသံလိုက်ပဲ့တင်ရိုက်ခတ်မှုနှင့်အချို့သောဏုပုံစံများကိုအသုံးပြုသည်။
လေးပုံတစ်ပုံဖွဲ့စည်းပုံ
အဆိုပါလေးပုံတစ်ပုံဖွဲ့စည်းပုံ (သို့မဟုတ် subunit, ဒိုမိန်း) တစ်ခုတည်းပရိုတိန်းရှုပ်ထွေးသော၏အစိတ်အပိုင်းတစ်ရပ်အဖြစ်အများအပြား polypeptide ချည်နှောင်ခြင်း၏အပြန်အလှန်အစီအစဉ်ဖြစ်ပါတယ်။အဆိုပါ quaternary ဖွဲ့စည်းပုံနှင့်အတူပရိုတိန်းဖွဲ့စည်းသောပရိုတိန်းမော်လီကျူးသည်ရိုင်ဗိုဇုမ်းများပေါ်တွင်သီးခြားစီဖွဲ့စည်းထားပါသည်နှင့်ပေါင်းစပ်၏အဆုံးပြီးနောက်သူတို့သာဘုံ supramolecular ဖွဲ့စည်းပုံဖွဲ့စည်းရန်ကြဘူး။ လေးပုံတစ်ပုံပရိုတိန်းတူညီခြင်းနှင့်ကွဲပြားခြားနားသော polypeptide ကွင်းဆက်နှစ်မျိုးလုံးပါဝင်နိုင်သည်။ အဆိုပါ Quaternary ဖွဲ့စည်းပုံ၏တည်ငြိမ်သည့်တက္ကသိုလ်၏တည်ငြိမ်အတွက်ကဲ့သို့တူညီသောအပြန်အလှန်အမျိုးအစားများပါဝငျသညျ။ Supramolecular protein ပရိုတိန်းများတွင်မော်လီကျူးများစွာပါဝင်သည်။
အဆောက်အ ဦး အမျိုးအစားအားဖြင့်ခွဲခြား
အထွေထွေဖွဲ့စည်းပုံအရပရိုတိန်းများကိုအုပ်စုသုံးစုခွဲနိုင်သည်။
- Fibrillar ပရိုတိန်းများ - ပိုလီမာကိုဖွဲ့စည်းသည်။ ပုံမှန်အားဖြင့် ၄ င်းတို့၏ဖွဲ့စည်းပုံသည်မတူညီသောချည်နှောင်မှုများအကြားဆက်သွယ်မှုများဖြစ်သည်။ သူတို့က microfilaments, microtubules, fibrils နှင့်ဆဲလ်များနှင့်တစ်ရှူးများ၏တည်ဆောက်ပုံကိုထောက်ပံ့ပေးသည်။ Fibrillar ပရိုတိန်းတွင် keratin နှင့် collagen တို့ပါဝင်သည်။
- ကမ္ဘာလုံးဆိုင်ရာပရိုတိန်းများသည်ရေတွင်ပျော်ဝင်နိုင်သည်၊ မော်လီကျူး၏ယေဘူယျပုံစံမှာလုံး ၀ သို့မဟုတ်လုံး ၀ နည်းသည်။
- အမြှေးပါးပရိုတိန်းများ - ဆဲလ်အမြှေးပါးကိုဖြတ်တဲ့နေရာများမှာဒိုမိန်းများရှိသည်။ သို့သော်၎င်းတို့ထဲမှအချို့သည်အမြှေးပါးမှဆဲလ်ပတ် ၀ န်းကျင်နှင့်ဆဲလ် cytoplasm သို့ထုတ်လွှတ်သည်။ အမြှေးပါးပရိုတိန်းသည် receptors များအနေဖြင့်လုပ်ဆောင်သည်။ ဆိုလိုသည်မှာ၎င်းတို့သည်အချက်ပြချက်များကိုထုတ်လွှင့်သည်။ ပရိုတိန်းသယ်ယူပို့ဆောင်ရေးသည်တိကျသောဖြစ်ပြီး၎င်းတို့တစ်ခုစီသည်အချို့သောမော်လီကျူးများသို့မဟုတ်အချို့သောအချက်ပြမှုများကိုအမြှေးပါးမှတဆင့်ဖြတ်သန်းသည်။
ရိုးရှင်းသောနှင့်ရှုပ်ထွေးသောပရိုတိန်း
peptide chains အပြင်ပရိုတိန်းများစွာတွင်အမိုင်နိုအက်ဆစ်မဟုတ်သောအုပ်စုများလည်းပါ ၀ င်သည်။ ဤသတ်မှတ်ချက်အရပရိုတိန်းများသည်အုပ်စုကြီးနှစ်ခုဖြစ်သောရိုးရှင်းပြီးရှုပ်ထွေးသောပရိုတိန်းများ (proteids) ဖြစ်သည်။ ရိုးရှင်းသောပရိုတင်းများသည် polypeptide chains များသာပါဝင်ပြီး၊ ရှုပ်ထွေးသောပရိုတိန်းများတွင်အမိုင်နိုအက်ဆစ်မဟုတ်သောပရိုတင်းများပါ ၀ င်သည်။ ပရိုတက်စတင့်အုပ်စုများ၏ဓာတုဗေဒသဘောသဘာဝအရရှုပ်ထွေးသောပရိုတိန်းများအနက်အောက်ပါသင်တန်းများကိုခွဲခြားထားသည်။
- covalently ဆက်နွယ်သောဘိုဟိုက်ဒရိတ်အကြွင်းအကျန်များကိုпротီလီယမ်အုပ်စုများပါ ၀ င်သည့် Glycoproteins များ၊ mucopolysaccharide အကြွင်းအကျန်များပါ ၀ င်သည့် glycoproteins proteoglycans ၏ subclass တွင်ပါ ၀ င်သည်။ serine သို့မဟုတ် threonine ၏ Hydroxyl အုပ်စုများများသောအားဖြင့်ဘိုဟိုက်ဒရိတ်အကြွင်းအကျန်နှင့်အတူတစ် ဦး နှောင်ကြိုး၏ဖွဲ့စည်းခြင်းတွင်ပါဝင်ပတ်သက်နေကြသည်။ extracellular ပရိုတင်းအများစုသည်အထူးသဖြင့် immunoglobulins များဖြစ်ပြီး glycoproteins ဖြစ်သည်။ proteoglycans များတွင်ကာဗိုဟိုက်ဒရိတ်သည်ပါဝင်သည်
ပရိုတိန်းမော်လီကျူး၏စုစုပေါင်းဒြပ်ထု၏ ၉၅% သည်၎င်းတို့သည် intercellular matrix ၏အဓိကအစိတ်အပိုင်းဖြစ်သည်။
သက်ရှိများ၏မျိုးပွား၏ 2. ဇီဝအရေးပါမှု။ မျိုးပွား၏နည်းလမ်းများ။
1. မျိုးပွားခြင်းနှင့်၎င်း၏အရေးပါမှု။
မျိုးပွါးခြင်း - ထောက်ပံ့ပေးသောအလားတူသက်ရှိမျိုးပွားခြင်း
ထောင်စုနှစ်များစွာအတွက်မျိုးစိတ်များတည်ရှိမှုသည်တိုးပွားလာစေသည်
မျိုးစိတ်များ၏တစ် ဦး ချင်းစီ၏အရေအတွက်, ဘဝ၏ဆက်လက်။ လိင်ပိုင်းဆိုင်ရာ, လိင်နှင့်
သက်ရှိများ၏အသီးအရွက်များပြန့်ပွား။
2. လိင်ကွဲမျိုးပွားခြင်းသည်ရှေးအကျဆုံးနည်းလမ်းဖြစ်သည်။ In
အများဆုံးလိင်ပိုင်းဆိုင်ရာတွင်ပါဝငျနေချိန်မှာသက်ရှိတ ဦး တည်း, sexlessness တွင်ပါဝင်ပတ်သက်သည်
တစ် ဦး ချင်းစီ။ အပင်များတွင်, အထူးဖော်စပ်ထားသုံးပြီး asexual မျိုးပွား - တ
အထူးပြုဆဲလ်။ ရေညှိ, မော့စ်, မြင်းမွှေး၏အထူးဖော်စပ်ထားအားဖြင့်ဝါဒဖြန့်,
လုယူခြင်း၊ အပင်များမှအပင်၏အဖုများ, အပင်ပေါက်ရန်အတွက်နှင့်ဖွံ့ဖြိုးတိုးတက်ရေးအတွက်
သူတို့ကိုအဆင်သင့်အခြေအနေများအတွက်အသစ်ကလက်အောက်ခံသက်ရှိ။ ကြီးမားတဲ့အရေအတွက်အသေခံ
အငြင်းပွားမှုဆိုးရွားသောအခြေအနေများသို့ကျသွား။ ဖြစ်ပျက်မှု၏အနိမ့်ဖြစ်နိုင်ခြေ
၎င်းတို့တွင်အာဟာရအနည်းငယ်ပါဝင်သောကြောင့်အထူးဖော်စပ်ထားများမှအသစ်သောသက်ရှိများနှင့်
ပျိုးပင်များသည်အဓိကအားဖြင့်ပတ်ဝန်းကျင်မှစုပ်ယူသည်။
3. ဟင်းသီးဟင်းရွက်ဝါဒဖြန့် - နှင့်အတူအပင်များပြန့်ပွား
အပင်များမှအင်္ဂါများကိုအသုံးပြုခြင်း - ဝေဟင်သို့မဟုတ်မြေအောက်အညွန့်များ၊ အမြစ်၏အစိတ်အပိုင်းများ၊
အရွက်, ဥ, မီးသီး။ တ ဦး တည်းသက်ရှိများ၏အပင်ဝါဒဖြန့်တွင်ပါဝင်ဆောင်ရွက်
သို့မဟုတ်ယင်း၏အစိတ်အပိုင်းများ။ ကအဖြစ်မိခင်နှင့်အတူသမီးစက်ရုံ၏ဆှဖှေဲ့
မိခင်၏ကိုယ်ခန္ဓာဖွံ့ဖြိုးတိုးတက်ရေးကိုဆက်လက်လုပ်ဆောင်သည်။ ကြီးမြတ်ထိရောက်မှုနှင့်
လက်ခွဲသက်ရှိတစ်ခုအနေဖြင့်သဘာဝအပင်မျိုးပွားမှုပျံ့နှံ့ခြင်း
ပိုမိုမြန်ဆန်သည့် Spore ထံမှထက်မိခင်အစိတ်အပိုင်းကနေဖွဲ့စည်းထားပါသည်။ ဟင်းသီးဟင်းရွက်ဥပမာများ
မွေးမြူရေး: အမြစ်တွယ် - သုံးပြီးချိုင့်၏နှင်း, ပူစီနံ, ဂျုံဆန်, စသည်တို့ကို
မြေဆီလွှာကိုထိနိမ့်အကိုင်းအခက် (အလွှာ) - Currant, ရိုင်းစပျစ်သီး, နှုတ်ခမ်းမွှေး
- စတော်ဘယ်ရီ, မီးသီး - Tulip, daffodil, Crocus ။ အသီးအရွက်များအသုံးပြုခြင်း
စိုက်ပျိုးသည့်အပင်များကြီးထွားလာသောအခါမျိုးပွားခြင်း - အာလူးကိုဥများကပြန့်ပွားစေသည်။
မီးသီးများ - ကြက်သွန်နီနှင့်ကြက်သွန်ဖြူ, အလွှာ - Currant နှင့်ဆီးဖြူ, အမြစ်
အမျိုးအနွယ် - ချယ်ရီသီး, Plum, ရှ - သစ်သီးပင်များ။
4. လိင်ပိုင်းဆိုင်ရာမျိုးပွား။ လိင်ပိုင်းဆိုင်ရာမျိုးပွားမှု၏အနှစ်သာရ
germ ဆဲလ် (gametes), အထီးပိုးဆဲလ်များ၏ပေါင်းစပ်ဖွဲ့စည်းခြင်းအတွက်
(သုက်ပိုး) နှင့်အမျိုးသမီး (ဥ) - မျိုးပွားခြင်းနှင့်အသစ်တစ်ခုဖြစ်ပေါ်လာခြင်း
တစ်ဓာတ်မြေသြဇာကြက်ဥကနေသမီးသက်ရှိ။ fertilization ကိုကျေးဇူးတင်ပါတယ်
ပိုမိုကွဲပြားခြားနားသောခရိုမိုဆုမ်းအစုံရှိလက်အောက်ခံသက်ရှိဖြစ်သည်
အမျိုးမျိုးသောမျိုးရိုးလိုက်သောစရိုက်များကြောင့်ရလဒ်ထွက်ပေါ်လာနိုင်သည်
ပိုပြီးနေရင်းဒေသများမှအဆင်ပြေအောင်။ လိင်ပိုင်းဆိုင်ရာမျိုးပွား၏ရှေ့မှောက်တွင်
ရေညှိ, မော့စ်, အတန်ကြာခံစား, gymnosperms နှင့် angiosperms ။ ရှုပ်ထွေး
သူတို့ရဲ့ဆင့်ကဲဖြစ်စဉ်ကာလအတွင်းအပင်များတွင်လိင်ဖြစ်စဉ်၊ အရှုပ်ထွေးဆုံးအရာဖြစ်သည်
အမျိုးအနွယ်ကိုအပင်များတွင်ပုံစံများ။
5. မျိုးစေ့ပွားများခြင်းသည်အစေ့၏အကူအညီဖြင့်ဖြစ်သည်။
၎င်းသည် gymnosperms နှင့် angiosperms (angiosperms) တို့၏လက္ခဏာဖြစ်သည်
ဟင်းသီးဟင်းရွက်များဝါဒဖြန့်လည်းကျယ်ပြန့်သည်။ အဆင့်များအဆင့်
အမျိုးအနွယ်ကိုပြန့်ပွားစေခြင်း - ၀ တ်မှုန်ကူးခြင်း - ဝတ်မှုန်ကို ၀ တ်မှုန်အိတ်၏အမည်းစက်သို့လွှဲပြောင်းပေးခြင်း
အပင်ပေါက်ရန်အတွက်, သုက်ပိုးနှစ်ခု, သူတို့ရဲ့တိုးတက်မှုခွဲဝေအားဖြင့်ပေါ်ပေါက်လာ
သုက်ပိုးတစ်ခုသည်သုက်ပိုးတစ်လုံးကိုဥနှင့်ပေါင်းစပ်ပြီးနောက်တစ်ခုနှင့်ပေါင်းစပ်သည်
(angiosperms အတွက်) အလယ်တန်းနျူကလိယ။ ovule အမျိုးအနွယ်မှဖွဲ့စည်းခြင်း -
သန္ဓေသား၏အာဟာရဓာတ်များနှင့်သန္ဓေသား၏နံရံမှသန္ဓေသား။ မျိုးစေ့ -
အသစ်သောအပင်တစ်မျိုး၏ပေါက်ကွဲမှုသည်အဆင်သင့်သောအခြေအနေများတွင်အပင်ပေါက်။ ပထမဆုံးအကြိမ်ဖြစ်သည်
ပျိုးပင်မျိုးစေ့၏အာဟာရများ၊ ထို့နောက်၎င်း၏အမြစ်များကိုကျွေးမွေးသည်
မြေဆီလွှာမှရေနှင့်တွင်းထွက်ပစ္စည်းများစုပ်ယူပြီးအရွက်များ - ကာဗွန်ဒိုင်အောက်ဆိုက်ဓာတ်ငွေ့
နေရောင်ခြည်ထဲမှာလေထဲကနေဓာတ်ငွေ့။ သစ်တစ်ခုစက်ရုံ၏လွတ်လပ်သောဘဝ။
ပရိုတိန်းဇီဝရူပဗေဒ
ဆဲလ်အတွင်းရှိပရိုတိန်း၏ရုပ်ပိုင်းဆိုင်ရာဂုဏ်သတ္တိများ၊ ရေအမြှေးပါးနှင့် macromolecules များပြည့် ၀ စွာထည့်သွင်းစဉ်းစားခြင်း (eng ။ ) အလွန်ရှုပ်ထွေး ပရိုတိန်း၏ကြိုတင်မှာယူထားသော“ crystal ကဲ့သို့သောစနစ်” (aperiodic crystal) အနေဖြင့် X-ray diffraction analysis (resolution ဖြင့် 1 angstrom အထိ)၊ မြင့်မားသောထုပ်ပိုးမှုသိပ်သည်းဆ၊ denaturation လုပ်ငန်းစဉ်၏ပူးပေါင်းဆောင်ရွက်မှုနှင့်အခြားအချက်အလက်များကထောက်ခံသည်။
အခြားအယူအဆတစ်ခု၏မျက်နှာသာပေးမှုတွင် intraglobular လှုပ်ရှားမှု (ကန့်သတ်ထားသော hopping (သို့) စဉ်ဆက်မပြတ်ပျံ့နှံ့မှုပုံစံ) ၏ပရိုတင်းများ၏အရည်ကဲ့သို့သောဂုဏ်သတ္တိများသည်နျူထရွန်ပြန့်နှံ့စမ်းသပ်မှုများ၊ Mössbauer spectroscopy ၏သက်သေသာဓကဖြစ်သည်။

တစ်လောကလုံးနည်းလမ်း: ရိုင်ဗိုဇုမ်းများအားပေါင်းစပ်
ပရိုတိန်းများကိုအမိုင်နိုအက်ဆစ်များမှသက်ရှိများမှမျိုးရိုးဗီဇတွင်ထည့်သွင်းထားသောသတင်းအချက်အလက်များအပေါ် အခြေခံ၍ ဖန်တီးသည်။ ပရိုတိန်းတစ်ခုချင်းစီတွင်ပရိုတိန်းကို encoding gene ၏ nucleotide sequence ကဆုံးဖြတ်သည့်ထူးခြားသည့်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များပါဝင်သည်။ မျိုးရိုးဗီဇကုဒ်သည်ဒီအင်အေ၏ဘေ့အပိုင်းအစများ (RNA မှတဆင့်) ကို polypeptide ကွင်းဆက်၏အမိုင်နိုအက်စစ်အစီအစဉ်သို့ဘာသာပြန်ဆိုသည့်နည်းလမ်းဖြစ်သည်။ ဤကုဒ်သည်ပရိုတိန်းတွင်ထည့်သွင်းထားသော RNA ခေါ် trinucleotide အပိုင်းများနှင့်ပရိုတိန်းတွင်ပါ ၀ င်သည့်အမိုင်နိုအက်ဆစ်များ၏ကိုက်ညီမှုကိုဆုံးဖြတ်သည်။ ဒီအင်အေတွင်ဘေ့စ်လေးခုပါဝင်သောကြောင့်စုစုပေါင်းဖြစ်နိုင်သည့်ကုတ်နံပါတ် ၆၄ ခု၊ အမိုင်နိုအက်ဆစ် ၂၀ ကိုပရိုတိန်းတွင်အသုံးပြုသောကြောင့်အမိုင်နိုအက်ဆစ်များစွာကို codon တစ်မျိုးထက် ပို၍ ဆုံးဖြတ်သည်။ codon သုံးခုသည်အရေးမကြီးပါ။ ၎င်းတို့သည် polypeptide ကွင်းဆက်၏ပေါင်းစပ်မှုအတွက် stop အချက်များအဖြစ်ရပ်တည်ပြီး termination codons သို့မဟုတ် stop codons များဟုခေါ်သည်။
ပရိုတိန်းများကို encoding genes များကိုပထမ ဦး ဆုံး RNA polymerase အင်ဇိုင်းများက messenger RNA (mRNA) ၏ nucleotide sequence သို့ကူးရေးသည်။ များစွာသောအမှုများတွင်သက်ရှိများ၏ပရိုတိန်းများကိုရိုင်ဗိုဇုမ်းများ - ဆဲလ်များ၏ cytoplasm တွင်ပါ ၀ င်သည့်ပေါင်းစပ်ဖွဲ့စည်းထားသောမော်လီကျူးစက်များတွင်ဖန်တီးသည်။ တစ် ဦး mRNA matrix ကိုအပေါ်တစ် ဦး ribosome အားဖြင့်တစ် ဦး polypeptide ကွင်းဆက်ဖန်တီး၏လုပ်ငန်းစဉ်ကိုဘာသာပြန်ချက်ဟုခေါ်သည်။
Ribosomal ပရိုတိန်းပေါင်းစပ်ခြင်းသည်အခြေခံအားဖြင့် prokaryotes နှင့် eukaryotes အတူတူပင်ဖြစ်သော်လည်းအသေးစိတ်နှင့်မတူပါ။ ထို့ကြောင့်ပရိုကာရီယို mRNA ကိုရိုင်ဗိုဇုမ်းများကပရိုတိန်း၏အမိုင်နိုအက်ဆစ်အစီအစဉ်သို့ချက်ချင်းကူးယူပြီးနောက်သို့မဟုတ်၎င်းသည်မပြီးဆုံးမီဖတ်ရှုနိုင်သည်။ eukaryotes တွင်အဓိကမှတ်တမ်းသည်ပြုပြင်ပြောင်းလဲမှုများစွာကို ဦး စွာဖြတ်ပြီး cytoplasm (ရိုင်ဗိုဇုမ်း၏တည်နေရာ) သို့ဘာသာပြန်ခြင်းကိုမစတင်မီ ဦး စွာသွားရမည်။ ပရိုတိန်းပေါင်းစပ်မှုနှုန်းသည်ပရိုကရိယော့ (စ်) များတွင်ပိုမိုမြင့်မားပြီးတစ်စက္ကန့်တွင်အမိုင်နိုအက်ဆစ် ၂၀ အထိရောက်ရှိနိုင်သည်။

ဘာသာပြန်ခြင်းမစတင်မီပင်အမိုင်နိုအက်စစ် -RNA synthetase အင်ဇိုင်းများသည်အမိုင်နိုအက်ဆစ်များကို၎င်းတို့၏သက်ဆိုင်ရာသယ်ယူပို့ဆောင်ရေး RNA (tRNA) နှင့်အထူးတွဲဖက်ထားသည်။ anticodon ဟုခေါ်သော tRNA ၏ဒေသသည် mRNA codon နှင့် တွဲဖက်၍ မျိုးရိုးဗီဇကုဒ်နှင့်အညီ polipeptide ကွင်းဆက်တွင် tRNA နှင့်တွဲဖက်သည့်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်ပါဝင်မှုကိုသေချာစေသည်။
ဘာသာပြန်၏ကန ဦး အဆင့်တွင်စတင်ခြင်း (များသောအားဖြင့် methionine) codon ကိုရိုင်ဗိုဇုမ်း၏သေးငယ်သည့် subunit မှအသိအမှတ်ပြုသည်။ aminoacylated methionine tRNA သည်ပရိုတိန်းအချက်များ အသုံးပြု၍ ပူးတွဲထားသည်။ start codon ကိုအသိအမှတ်ပြုပြီးနောက် subunit အကြီးသည်ရိုင်ဗိုဇုမ်း၏ subunit အငယ်စားနှင့်ပူးပေါင်းပြီးဒုတိယအဆင့်သည် elongation ကိုဘာသာပြန်ခြင်းစတင်သည်။ mRNA ၏ 5'- 3'-end မှရိုင်ဗိုဇုမ်း၏အဆင့်တစ်ခုစီတိုင်းတွင် codon တစ်ခုသည်ဟိုက်ဒရိုဂျင်နှောင်ကြိုးဖွဲ့စည်းခြင်းနှင့်၎င်းနှင့်လိုက်ဖက်သည့်သယ်ယူပို့ဆောင်ရေး RNA နှင့်သက်ဆိုင်သောအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်ကိုပူးတွဲဖော်ပြသည်။ ကြီးထွားလာနေသော peptide ၏နောက်ဆုံးအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်နှင့် tRNA နှင့်တွဲဖက်သည့်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များအကြား peptide နှောင်ကြိုးဖွဲ့စည်းခြင်းသည်ရိုင်ဗိုဇုမ်း၏ peptidyl transferase စင်တာကိုဖွဲ့စည်းပေးသော ribosomal RNA (rRNA) ကဓာတ်ကူပစ္စည်းဖြစ်သည်။ ဤအလယ်ဗဟိုတွင်နိုက်ထရိုဂျင်နှင့်ကာဗွန်အက်တမ်တို့ကိုဓါတ်ပြုပြီးစီးသောနေရာအတွက်အဆင်သင့်ဖြစ်စေသည်။ ribosome သည် stop codon သို့ရောက်သောအခါဘာသာပြန်ခြင်း၏တတိယနှင့်နောက်ဆုံးအဆင့်ကိုအဆုံးသတ်သည်။ ပရိုတိန်း၏အဆုံးသတ်အချက်သည်နောက်ဆုံး tRNA နှင့် polypeptide ကွင်းဆက်များအကြားဆက်နွယ်မှုကိုဟိုက်ဒရောလစ်အားရပ်တန့်စေပြီး၊ ရိုင်ဗိုဇုမ်းများအားပရိုတိန်းများကို N- မှ C-terminus သို့အမြဲတမ်းဖန်တီးသည်။
Neribosomal ပေါင်းစပ်
အနိမ့်မှိုများနှင့်အချို့သောဘက်တီးရီးယားများတွင်အများအားဖြင့်သေးငယ်။ ပုံမှန်မဟုတ်သောဖွဲ့စည်းတည်ဆောက်ပုံရှိသော peptides ၏ biosynthesis ၏နောက်ထပ် (ribosomal, သို့မဟုတ် multienzyme) နည်းလမ်းကိုလူသိများသည်။ဤ peptides များ၊ များသောအားဖြင့်အလယ်အလတ်ဇီဝြဖစ်ပျက်မှုများကိုပေါင်းစပ်ခြင်း၊ မြင့်မားသောမော်လီကျူးအလေးချိန်ပရိုတိန်းရှုပ်ထွေးသော NRS synthase သည်ရိုင်ဗိုဇုမ်းများ၏တိုက်ရိုက်ပါဝင်မှုမရှိဘဲပြုလုပ်သည်။ အများအားဖြင့် NRS synthase တွင်အမိုင်နိုအက်ဆစ်များကိုရွေးချယ်ပြီး၊ peptide bond ဖြစ်ပေါ်စေပြီး synthesized peptide ကိုထုတ်လွှတ်သော domain များသို့မဟုတ်ပရိုတင်းတစ်ခုချင်းစီပါ ၀ င်သည်။ အတူတူ, ဤ domains များ module တစ်ခုဖွင့်ပါစေ။ တစ်ခုချင်းစီကို module တစ်ခုဖန်တီး peptide အတွက်တ ဦး တည်းအမိုင်နိုအက်ဆစ်များပါဝင်သေချာ။ NRS synthases များသည်တစ်ခုသို့မဟုတ်တစ်ခုထက်ပိုသော module များဖြင့်ဖွဲ့စည်းနိုင်သည်။ တခါတရံတွင်ဤရှုပ်ထွေးသောနေရာများတွင် L-amino acids (ပုံမှန်ပုံစံ) ကို D-form အဖြစ်ပြောင်းလဲရန်စွမ်းရည်ရှိသောဒိုမိန်းတစ်ခုပါ ၀ င်သည်။
ဓာတုဗေဒပေါင်းစပ်
ပရိုတိန်းတိုများကိုဓာတုဗေဒနည်းဖြင့်ဖန်တီးနိုင်သည်။ ရိုင်ဗိုဇုမ်းဇီဝပေါင်းစပ်မှုနှင့်ဆန့်ကျင်။ အများအားဖြင့်၊ peptide ၏ဓာတုဗေဒဆိုင်ရာပေါင်းစပ်မှုသည် C-terminus မှ N-terminus သို့ ဦး တည်သည်။ ဓာတုဗေဒပေါင်းစပ်နည်းသည် immunogenic peptides (epitopes) များကိုထုတ်ပေးသည်။ ထို့နောက်တိဗက် antibodies သို့မဟုတ် hybridomas ရရှိရန်တိရိစ္ဆာန်များထဲသို့ထိုးသွင်းသည်။ ထို့အပြင်ဤနည်းလမ်းကိုအချို့အင်ဇိုင်းများ၏ inhibitors ရရှိရန်လည်းအသုံးပြုသည်။ ဓာတုဗေဒဆိုင်ရာပေါင်းစပ်မှုကသမားရိုးကျပရိုတိန်းများ၌မတွေ့ရသည့်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များကိုမိတ်ဆက်ပေးသည်။ ပရိုတိန်းများပေါင်းစပ်မှုအတွက်ဓာတုဗေဒနည်းစနစ်များသည်ကန့်သတ်ချက်များစွာရှိသည်။ ပရိုတိန်းအရှည် ၃၀၀ ကျော်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များနှင့်ထိရောက်မှုမရှိ၊
ဘာသာပြန်ပြီးနောက်ပြုပြင်မွမ်းမံခြင်း

ဘာသာပြန်မှုပြီးဆုံးသွားသောအခါပရိုတိန်းအများစုသည် post-translational modifications ဟုခေါ်သောနောက်ထပ်ဓာတုဗေဒဆိုင်ရာပြုပြင်ပြောင်းလဲမှုများကိုခံယူသည်။ ပရိုတိန်း၏လွန်ခဲ့သောနှစ်ပေါင်းနှစ်ရာကျော်ကိုပရိုတိန်း၏ပြောင်းလဲမှုများကိုလူသိများသည်။
ဘာသာပြောင်းပြီးနောက်ပြုပြင်ပြောင်းလဲမှုသည်ဆဲလ်ရှိပရိုတင်းများ၏သက်တမ်း၊ သူတို့၏အင်ဇိုင်းပြုမှုလုပ်ဆောင်မှုနှင့်အခြားပရိုတိန်းများနှင့်အပြန်အလှန်ဆက်သွယ်မှုများကိုထိန်းညှိနိုင်သည်။ အချို့သောကိစ္စရပ်များတွင်ဘာသာပြောင်းပြီးနောက်ပြုပြင်ပြောင်းလဲမှုများသည်ပရိုတိန်းရင့်ကျက်မှု၏မဖြစ်မနေလိုအပ်သောအဆင့်တစ်ခုဖြစ်သည်။ ဥပမာအားဖြင့်အင်ဆူလင်နှင့်အခြားဟော်မုန်းများရင့်ကျက်မှုနှင့်အတူ polypeptide ကွင်းဆက်၏ proteolysis အကန့်အသတ်လိုအပ်သည်။ Plasma အမြှေးပါးပရိုတိန်းများရင့်ကျက်မှုနှင့်အတူ glycosylation လိုအပ်သည်။
ဘာသာပြန်ပြီးနောက်ပြုပြင်မွမ်းမံခြင်းများသည်ကျယ်ပြန့်ခြင်းနှင့်ရှားပါးခြင်းဖြစ်နိုင်ပြီးထူးခြားသောအရာများအထိဖြစ်သည်။ တစ်လောကလုံးပြုပြင်မွမ်းမံ၏ဥပမာတစ်ခု ubiquitination (proteasome အားဖြင့်ဒီပရိုတိန်း၏ cleavage များအတွက်အချက်ပြအဖြစ်တာဝန်ထမ်းဆောင်သောတိုတောင်းတဲ့ ubiquitin ပရိုတိန်း၏မော်လီကျူးအများအပြားမော်လီကျူး၏ကွင်းဆက်၏ပူးတွဲမှု) ဖြစ်ပါသည်။ နောက်ထပ်ဘုံပြုပြင်ခြင်းမှာ glycosylation ဖြစ်သည်။ ၎င်းသည်လူ့ပရိုတိန်း၏ထက်ဝက်ခန့်သည် glycosylated ဖြစ်သည်။ ရှားပါးသောပြုပြင်မွမ်းမံမှုများတွင် tyrosination / detirozination နှင့် tubulin ၏ polyglycylation တို့ပါဝင်သည်။
တ ဦး တည်းနှင့်တူညီသောပရိုတိန်းမြောက်မြားစွာပြုပြင်မွမ်းမံခြင်းကိုခံနိုင်သည်။ ဒါကြောင့်ကွဲပြားခြားနားသောအခြေအနေများအောက်တွင် histones (eukaryotes အတွက် chromatin ၏အစိတ်အပိုင်းဖြစ်ကြောင်းပရိုတိန်း) 150 ကျော်ကွဲပြားခြားနားသောပြုပြင်မွမ်းမံခံယူနိုင်ပါတယ်။
ဘာသာပြန်ပြီးနောက်ပြုပြင်ခြင်းကိုခွဲခြားထားသည် -
- အဓိက circuit ပြုပြင်မွမ်းမံမှုများ၊
- N-terminal methionine အကြွင်းအကျန်များ
- ကန့်သတ်ထားသော proteolysis - အဆုံးသတ် (signal sequences of split) သို့မဟုတ်အချို့ကိစ္စများတွင်၊ မော်လီကျူး၏အလယ်တွင် (အင်ဆူလင်ရင့်ကျက်ခြင်း) မှဖြစ်ပေါ်နိုင်သောပရိုတင်းအပိုင်းအစတစ်ခုကိုဖယ်ရှားခြင်း၊
- အမျိုးမျိုးသောဓာတုဗေဒအုပ်စုများကိုအမိုင်နိုနှင့်ကာဗွန်အက်စစ်များ (တွဲဆက်ခြင်း၊ N-acylation, myristoylation) စသည်တို့ဖြင့်ပူးတွဲထားသည်။
- အမိုင်နိုအက်ဆစ်များ၏ဘေးထွက်ချည်နှောင်ခြင်းကိုပြုပြင်မွမ်းမံခြင်း,
- သေးငယ်သောဓါတုဗေဒအုပ်စုများ (glycosylation, phosphorylation, etc) ၏ဖြည့်စွက်ခြင်းသို့မဟုတ်ကွဲခြင်း၊
- lipids နှင့် hydrocarbons များအပြင်
- စံအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များကိုပုံမှန်မဟုတ်သော (citrulline ဖွဲ့စည်းခြင်း) ပြောင်းလဲခြင်း၊
- cysteine အကြွင်းအကျန်များအကြား disulfide တံတားများဖွဲ့စည်းခြင်း,
- သေးငယ်တဲ့ပရိုတိန်း (sumoylation နှင့်နေရာအနှံ့) ၏ထို့အပြင်။
Intracellular သယ်ယူပို့ဆောင်ရေးနှင့် sorting
eukaryotic ဆဲလ်၏ cytoplasm တွင်ဖန်တီးထားသောပရိုတိန်းများကိုဆဲလ် organoids များသို့သယ်ဆောင်ရမည်။ နျူကလိယ၊ mitochondria၊ endoplasmic reticulum (EPR), Golgi ယန္တရား၊ lysosomes စသည်တို့ဖြစ်သည်။ ဆဲလ်၏အချို့အပိုင်းသို့ရောက်ရန်ပရိုတိန်းသည်တိကျသောတံဆိပ်ကပ်ရမည်။ ကိစ္စရပ်အများစုတွင်၊ ထိုကဲ့သို့သောတံဆိပ်ကပ်ခြင်းသည်ပရိုတိန်း၏အမိုင်နိုအက်ဆစ်အစဉ်လိုက်၏အစိတ်အပိုင်းဖြစ်သည် (ခေါင်းဆောင် peptide, သို့မဟုတ်ပရိုတိန်း၏ signal sequence), သို့သော်အချို့ကိစ္စများတွင်ပရိုတိန်းနှင့်တွဲဖက်သည့် oligosaccharides သည်တံဆိပ်ဖြစ်သည်။
ရိုင်ဗိုဇုမ်းများအားအချက်ပြသည့်အစီအစဉ်နှင့်အတူပရိုတိန်းများကို၎င်း၏အပြင်ဘက်အမြှေးပါးပေါ်ရှိအထူးပရိုတိန်းများပေါ်တွင်“ ထိုင်” ခြင်းကြောင့် EPR ရှိပရိုတိန်းများအားသယ်ယူပို့ဆောင်ရေးကို၎င်းတို့ကိုပေါင်းစပ်ထားသည်။ EPR မှသည် Golgi ယန္တရားသို့၊ ထိုမှစ။ lysosomes နှင့်အပြင်ဘက်အမြှေးပါးသို့သို့မဟုတ် extracellular medium သို့ပရိုတိန်းများသည် vesicular သယ်ယူပို့ဆောင်ရေးမှတဆင့်ဝင်ရောက်သည်။ နျူကလီးယားပြန့်နှံ့မှုအချက်ပြမှုဖြင့်ပရိုတင်းများသည်နျူကလိယကိုအဏုမြူအပေါက်များမှတဆင့်ဝင်ရောက်သည်။ mitochondria နှင့် chloroplasts တွင်သက်ဆိုင်ရာ signal sequences များရှိသောပရိုတိန်းများသည် chaperones ၏ပါဝင်မှုနှင့်အတူတိကျသောပရိုတိန်းဘာသာပြန်သူအပေါက်မှတစ်ဆင့်ဝင်ရောက်သည်။
ဖွဲ့စည်းပုံနှင့်ပျက်စီးခြင်းကိုထိန်းသိမ်း
ပရိုတိန်း၏မှန်ကန်သော Spatial ဖွဲ့စည်းပုံကိုထိန်းသိမ်းခြင်းသည်သူတို့၏ပုံမှန်လည်ပတ်မှုအတွက်အရေးကြီးသည်။ ဓာတ်တိုးခြင်း၊ စိတ်ဖိစီးမှုအခြေအနေများ (သို့) ကမ္ဘာလုံးဆိုင်ရာဆဲလ်များ၏ဇီဝကမ္မဗေဒဆိုင်ရာပြောင်းလဲမှုများကြောင့်ဖြစ်ပေါ်လာနိုင်သည်။ ပရိုတိန်းများစုစည်းခြင်းသည်အိုမင်းခြင်း၏လက္ခဏာဖြစ်သည်။ မသင့်လျော်သောပရိုတိန်းများခေါက်ထားခြင်းသည် cystic fibrosis, lysosomal စုဆောင်းခြင်းရောဂါကဲ့သို့သောရောဂါများကိုဖြစ်စေသည်သို့မဟုတ်ပိုမိုဆိုးရွားစေသည်ဟုယုံကြည်ရသည်။ neurodegenerative disorders (Alzheimer, Huntington နဲ့ Parkinson) တို့ပါ။
ဆဲလ်ဆင့်ကဲဆင့်ကဲဖြစ်စဉ်တွင်ပရိုတိန်းစုစည်းမှုကိုတန်ပြန်ရန်အဓိကယန္တရား ၄ ခုကိုတီထွင်ခဲ့ကြသည်။ ပထမအချက်နှစ်ချက်ကို chaperones ၏အကူအညီဖြင့်ထပ်ခါတလဲလဲခေါက်။ (refolding) လုပ်ခြင်းနှင့် proteases များဖြင့်ခွဲထွက်ခြင်းတို့ကိုဘက်တီးရီးယားနှင့်အဆင့်မြင့်သက်ရှိများတွင်တွေ့ရသည်။ Autophagy နှင့်အထူးမဟုတ်သောအမြှေးပါး Non-membrane organelles များတွင်မလျော်ကန်သောခေါက်ထားသောပရိုတင်းများစုဆောင်းခြင်းသည် eukaryotes ၏လက္ခဏာဖြစ်သည်။

denaturation ပြီးနောက်မှန်ကန်သောသုံးဖက်မြင်ဖွဲ့စည်းပုံကိုပြန်လည်ထူထောင်ရန်ပရိုတိန်း၏စွမ်းရည်သည်ပရိုတိန်း၏နောက်ဆုံးတည်ဆောက်ပုံနှင့်ပတ်သက်သောသတင်းအချက်အလက်အားလုံးကို၎င်း၏အမိုင်နိုအက်ဆစ်အစီအစဉ်တွင်ပါ ၀ င်သည်ဟုယူဆရန်ခွင့်ပြုခဲ့သည်။ လက်ရှိပရိုတိန်း၏တည်ငြိမ်မှုညီညွတ်မှုအနည်းဆုံးအခမဲ့စွမ်းအင်ရှိကြောင်းသီအိုရီကိုဒီ polypeptide ၏အခြားဖြစ်နိုင်သောခွေးနှင့်နှိုင်းယှဉ်ထားသည်။
ဆဲလ်များ၌ပရိုတိန်းများရှိသည်။ ၄ င်းတို့၏လုပ်ဆောင်ချက်သည်ရိုင်ဗိုဇုမ်းဖြင့်ပေါင်းစပ်ပြီးနောက်အခြားပရိုတိန်းများအားမှန်ကန်သောခေါက်သိမ်းဆည်းရန်၊ ပရိုတိန်းများ၏ဖွဲ့စည်းတည်ဆောက်ပုံကိုပြန်လည်ထူထောင်ရန်နှင့်ပရိုတင်းရှုပ်ထွေးမှုများကိုဖန်တီးရန်နှင့်ခွဲထုတ်ရန်ဖြစ်သည်။ ဒီပရိုတင်းတွေကို chaperones လို့ခေါ်တယ်။ ပတ် ၀ န်းကျင်အပူချိန်သိသိသာသာမြင့်တက်လာသည်နှင့်အမျှဆဲလ်ထဲတွင်များစွာသော chaperones များ၏အာရုံစူးစိုက်မှုသည်မြင့်တက်လာသဖြင့်၎င်းတို့သည် Hsp အုပ်စုဝင် (English shock shock protein - heat shock protein) ဖြစ်သည်။ လူ့ကိုယ်ခန္ဓာ၏လည်ပတ်မှုအတွက် chaperones ၏ပုံမှန်လည်ပတ်မှု၏အရေးပါမှုကိုလူ့မျက်စိ၏မှန်ဘီလူးဖြစ်သည့်α-crystallin chaperone ၏ဥပမာအားဖြင့်ဥပမာပြနိုင်သည်။ ဤပရိုတိန်းရှိဗီဇပြောင်းလဲခြင်းသည်ပရိုတိန်းများစုစည်းမှုကြောင့်နှင့်မျက်စိအတွင်းတိမ်ဖြစ်ပေါ်ခြင်းကြောင့်မှန်ဘီလူးကိုတိမ်ခြင်းဖြစ်စေသည်။
ပရိုတိန်း၏တတိယအဆင့်ဖွဲ့စည်းပုံကိုပြန်လည်မရရှိနိုင်ပါက၎င်းတို့ကိုဆဲလ်များကဖျက်ဆီးပစ်သည်။ ပရိုတိန်းများကိုအဆင့်နိမ့်စေသောအင်ဇိုင်းများကိုပရိုတင်းများဟုခေါ်သည်။အဆိုပါအလွှာမော်လီကျူး၏တိုက်ခိုက်မှု site မှာ, proteolytic အင်ဇိုင်းတွေ endopeptidases နှင့် exopeptidases သို့ခွဲခြားထားတယ်:
- Endopeptidases (ပရိုတင်းဓာတ်) များသည် peptide ကွင်းဆက်အတွင်းရှိ peptide bonds များကိုတွယ်ကပ်သည်။ သူတို့ကအလွှာများ၏ peptide ပာ၏တိုတောင်းသောပာကိုအသိအမှတ်ပြုပြီးအထူးသဖြင့်အချို့သောအမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များအကြားရှိနှောင်ကြိုးများကို hydrolyze ။
- Exopeptidases သည်ကွင်းဆက်စွန်းများမှ peptides hydrolyze: N-terminus မှ aminopeptidases, C-terminus မှ carboxypeptidases ။ နောက်ဆုံးအနေဖြင့် dipeptidases များသည် dipeptides များကိုသာမှီခိုသည်။
ဓာတ်ကူပစ္စည်းဖြစ်စဉ်၏အဆိုအရအပြည်ပြည်ဆိုင်ရာဇီဝဓာတုဗေဒနှင့်မော်လီကျူးဇီဝဗေဒသည် serine proteases, aspartic proteases, cysteine proteases နှင့် metalloproteases စသည့်ပရိုတင်းများအားအတန်းခွဲခြားသတ်မှတ်သည်။
အထူးပရိုတင်းဓာတ်အမျိုးအစားမှာ proteasome ဖြစ်သည်။ နျူကလိယနှင့် eukaryotes၊ Archaea နှင့်အချို့သောဘက်တီးရီးယားများ၏ cytoplasm တွင်ရှိသည့် multisubunit protease ဖြစ်သည်။
proteasome အားဖြင့်ပစ်မှတ်ပရိုတိန်းကိုဖြိုဖျက်နိုင်ရန်အတွက်၎င်းကိုသေးငယ်သော ubiquitin protein ကို ကပ်၍ တံဆိပ်တပ်ရမည်။ ubiquitin ၏ဖြည့်စွက်တုံ့ပြန်မှုကို ubiquitin ligases များကအင်ဇိုင်းများကဓာတ်ကူပေးသည်။ ပရိုတိန်းသို့ပထမ ဦး ဆုံး ubiquitin မော်လီကျူး၏ထည့်သွင်းခြင်း ubiquitin မော်လီကျူးများထပ်မံဖြည့်စွက်ခြင်းအတွက် ligases များအတွက်အချက်ပြဖြစ်သည်။ ရလဒ်အနေဖြင့် polyubiquitin ကွင်းဆက်သည်ပရိုတိန်းနှင့်တွဲထားသည်။ ၎င်းသည် proteasome နှင့်ဆက်နွယ်ပြီးပစ်မှတ်ပရိုတိန်း၏ကွဲထွက်မှုကိုသေချာစေသည်။ ယေဘူယျအားဖြင့်ဤစနစ်ကို ubiquitin-dependant protein protein degradation ဟုခေါ်သည်။ intracellular ပရိုတင်းများ၏ 80-90% ၏ပျက်စီးခြင်း proteasome ၏ပါဝင်မှုနှင့်အတူတွေ့ရှိနိုင်ပါသည်။
Peroxisomes တွင်ပရိုတိန်းပျက်စီးခြင်းသည်ဆဲလ်သံသရာ၊ ဗီဇဖော်ပြမှုနှင့်စည်းမျဉ်းစည်းကမ်းများနှင့် oxidative stress ကိုတုန့်ပြန်မှုအပါအ ၀ င်ဆယ်လူလာလုပ်ငန်းစဉ်များအတွက်အရေးကြီးသည်။

Autophagy သည်သက်တမ်းရှည်ဇီဝမော်လီကျူးများအထူးသဖြင့်ပရိုတိန်းများ၊ lysosomes (နို့တိုက်သတ္တဝါများ) တွင်ရှိသော organelles (တဆေးထဲတွင်) vacuoles ၏ပျက်စီးခြင်းဖြစ်စဉ်ဖြစ်သည်။ Autophagy သည်ပုံမှန်ဆဲလ်များ၏အရေးကြီးသောလုပ်ဆောင်မှုနှင့်အတူပါ ၀ င်သည်။ သို့သော်အာဟာရမရှိခြင်း၊ cytoplasm တွင်ပျက်စီးသွားသောအော်ဂဲနစ်များရှိနေခြင်းနှင့်နောက်ဆုံးတွင်တစ်စိတ်တစ်ပိုင်း denatured ပရိုတိန်းများနှင့် cytoplasm တွင် ၄ င်းတို့၏စုစည်းမှုများရှိနေခြင်းသည်ဆဲလ်များ၌ autophagy ၏ဖြစ်စဉ်များကိုတိုးတက်စေရန်လှုံ့ဆော်ပေးသည်။
autophagy အမျိုးအစားသုံးမျိုးခွဲခြားထားပါသည်: microautophagy, macroautophagy နှင့် chaperone- မှီခို autophagy ။
microautophagy စဉ်အတွင်း macromolecules နှင့်ဆဲလ်အမြှေးပါး၏အပိုင်းအစများ lysosome အားဖြင့်ဖမ်းဆီးရမိ။ ဤနည်းအားဖြင့်ဆဲလ်သည်စွမ်းအင်သို့မဟုတ်ဆောက်လုပ်ရေးပစ္စည်း (ဥပမာအစာငတ်မွတ်စဉ်အခါ) မရှိခြင်းနှင့်ပရိုတိန်းများကိုအစာကြေနိုင်သည်။ သို့သော် microautophagy ၏ဖြစ်စဉ်များပုံမှန်အခြေအနေများအောက်တွင်ပေါ်ပေါက်ယေဘုယျအားဖြင့်ခွဲခြားဆက်ဆံမှုမရှိပါ။ တစ်ခါတစ်ရံတွင် organoids များကို microautophagy တွင်ကြေညက်သည်။ ဥပမာအားဖြင့် peroxisomes ၏ microautophagy နှင့်ဆဲလ်ရှင်သန်နိုင်သည့်နျူကလိယများ၏တစ်စိတ်တစ်ပိုင်း microautophagy ကိုတဆေးထဲတွင်ဖော်ပြထားသည်။
macroautophagy တွင် cytoplasm ၏အစိတ်အပိုင်း (မကြာခဏဆိုသလို organoids များပါ ၀ င်သည်) သည် endoplasmic reticulum ၏ရေလှောင်ကန်နှင့်ဆင်တူသည့်အမြှေးပါးအခန်းတစ်ခုဖြင့်ဝိုင်းရံထားသည်။ ရလဒ်အနေဖြင့်ဤ site သည် cytoplasm ၏ကျန်နှင့်အမြှေးပါးနှစ်ခုဖြင့်ကွဲသွားသည်။ ထိုသို့သောအမြှေးပါးအလွှာရှိသောအော်ဂယ်လ်ကို autophagosomes ဟုခေါ်သည်။ Autophagosomes များသည် lysosomes များနှင့်ပေါင်းပြီး autophagolysosomes များကိုဖွဲ့စည်းသည်။ organelles နှင့် autophagosomes များထဲမှပါဝင်သောအရာများသည်အစာကြေသည်။ ရှင်းနေသည်မှာ macroautophagy သည်ဆဲလ်သည်“ သက်တမ်းကုန်ပြီ” (mitochondria, ribosomes) စသော organoids များကိုဖယ်ရှားပစ်နိုင်ကြောင်းမကြာခဏအလေးပေးဖော်ပြသော်လည်း၊
တတိယအမျိုးအစား autophagy သည် chaperone-dependence ဖြစ်သည်။ ဤနည်းလမ်းတွင် cytoplasm မှတစ်စိတ်တစ်ပိုင်း denatured ပရိုတိန်းများအား ၄ င်းတို့၏အခေါင်းပေါက်ဆီသို့ lysosome အမြှေးပါးမှတဆင့်သယ်ယူပို့ဆောင်သည်။ ဤအမျိုးအစားသည်နို့တိုက်သတ္တဝါများတွင်သာဖော်ပြလေ့ရှိပြီးစိတ်ဖိစီးမှုကြောင့်ဖြစ်ပေါ်စေသည်။

JUNQ နှင့် IPOD
စိတ်ဖိစီးမှုအောက်တွင် eukaryotic ဆဲလ်သည် denatured ပရိုတိန်းများစွာစုဆောင်းခြင်းကိုမဖြေရှင်းနိုင်သည့်အခါ၎င်းသည်ယာယီ organelles အမျိုးအစားနှစ်မျိုးဖြစ်သော JUNQ နှင့် IPOD (English) Russian သို့ပို့နိုင်သည်။ ။
JUNQ (Eng ။ JUxta Nuclear အရည်အသွေးထိန်းချုပ်မှုအခန်း) သည်နျူကလီးယားအမြှေးပါး၏အပြင်ဘက်ခြမ်းနှင့်ဆက်စပ်မှုရှိပြီး cytoplasm သို့လျင်မြန်စွာလွှဲပြောင်းနိုင်သည့် Ubiquitinated protein များအပြင် chaperones နှင့် proteasomes တို့ပါဝင်သည်။ JUNQ ၏ရည်ရွယ်ချက်မှာပရိုတိန်းများကို refolde နှင့် / သို့မဟုတ် degrade လုပ်ရန်ဖြစ်သည်။
IPOD (ပျော်ဝင်နိုင်သောပရိုတိန်းသိုက်) သည်အလယ်ပိုင်း vacuole အနီးတွင်ရှိပြီး amyloid ဖွဲ့စည်းသည့်ပရိုတိန်းများ၏ရွေ့လျားစုစည်းမှုများပါရှိသည်။ IPOD တွင်ဤပရိုတိန်းများစုဆောင်းခြင်းသည်ပုံမှန်ဆယ်လူလာအဆောက်အ ဦ များနှင့်၎င်းတို့၏အပြန်အလှန်ဆက်သွယ်မှုကိုတားဆီးနိုင်သည်။ ထို့ကြောင့်၎င်းပါဝင်မှုသည်အကာအကွယ်လုပ်ဆောင်မှုတစ်ခုဖြစ်သည်ဟုယုံကြည်ရသည်။
ခန္ဓာကိုယ်ထဲမှာပရိုတိန်း၏လုပ်ဆောင်ချက်များကို
အခြားသောဇီဝဗေဒဆိုင်ရာအဏုကြည့်မှန်ပြောင်းများ (polysaccharides, lipids နှင့် nucleic acids) ကဲ့သို့ပင်ပရိုတိန်းများသည်သက်ရှိအားလုံး၏မရှိမဖြစ်လိုအပ်သောအစိတ်အပိုင်းများဖြစ်ပြီးဆဲလ်၏ဘဝတွင်အရေးပါသောအခန်းကဏ္ play မှပါ ၀ င်သည်။ ပရိုတိန်းသည်ဇီဝဖြစ်စဉ်ဖြစ်စဉ်များကိုလုပ်ဆောင်သည်။ ၎င်းတို့သည်ဆဲလ်များအကြားထုတ်လွှင့်သောအချက်ပြမှုတစ်ခုအဖြစ်လုပ်ဆောင်နိုင်ပြီး၊ အစားအစာ၏ hydrolysis နှင့် intercellular ပစ္စည်းများ၏ဖွဲ့စည်းခြင်းတွင်ပါ ၀ င်နိုင်သည့် organelles နှင့် cytoskeleton တို့သည် intracellular ဖွဲ့စည်းပုံ၏အစိတ်အပိုင်းတစ်ခုဖြစ်သည်။
ပရိုတိန်းအမျိုးအစားများသည် ၄ င်းတို့၏လုပ်ဆောင်ချက်များနှင့်အညီကွဲပြားခြားနားသည်။ အကြောင်းမှာတူညီသောပရိုတိန်းသည်လုပ်ဆောင်မှုများစွာကိုလုပ်ဆောင်နိုင်သောကြောင့်ဖြစ်သည်။ ထိုကဲ့သို့သောဘက်စုံသုံးလုပ်ဆောင်မှုဆိုင်ရာကောင်းစွာလေ့လာသည့်ဥပမာတစ်ခုမှာ lysyl tRNA synthetase, aminoacyl tRNA synthetases အတန်းမှအင်ဇိုင်းတစ်ခုဖြစ်သည်။ ၎င်းသည် lysine အကြွင်းအကျန်ကို tRNA နှင့်ချိတ်ဆက်ရုံသာမကမျိုးရိုးဗီဇများစွာကူးယူခြင်းကိုလည်းထိန်းချုပ်သည်။ ပရိုတင်းများသည်သူတို့၏အင်ဇိုင်းများလုပ်ဆောင်မှုကြောင့်လုပ်ဆောင်မှုများစွာကိုလုပ်ဆောင်သည်။ ဒီတော့အင်ဇိုင်းတွေဟာမော်တာပရိုတိန်း myosin, စည်းမျဉ်းပရိုတိန်း kinase ပရိုတိန်း, သယ်ယူပို့ဆောင်ရေးပရိုတိန်းဆိုဒီယမ် - ပိုတက်စီယမ် adenosine triphosphatase, etc ဖြစ်ကြသည်။

Catalytic function ကို
ခန္ဓာကိုယ်အတွင်းရှိပရိုတိန်း၏အကျော်ကြားဆုံးသောလုပ်ဆောင်ချက်မှာဓာတုဓာတ်ပြုမှုအမျိုးမျိုးကိုဓာတ်ကူပစ္စည်းဖြစ်သည်။ အင်ဇိုင်းများသည်တိကျသောဓာတ်ကူပစ္စည်းဂုဏ်သတ္တိများရှိသောပရိုတိန်းများဖြစ်သည်။ အင်ဇိုင်းများသည် DNA ပွားခြင်းနှင့်ပြုပြင်ခြင်းနှင့် matrix RNA ပေါင်းစပ်ခြင်းတို့အပါအဝင်ရှုပ်ထွေးသောမော်လီကျူးများ (catabolism) နှင့်သူတို့၏ပေါင်းစပ်ခြင်း (ခန္ဓာဗေဒပြောင်းလဲမှု) တို့ကိုခွဲထုတ်သည်။ ၂၀၁၃ ခုနှစ်တွင်အင်ဇိုင်းပေါင်း ၅၀၀၀ ကျော်ကိုဖော်ပြခဲ့သည်။ enzymatic ဓာတ်ကူပစ္စည်း၏ရလဒ်အနေဖြင့်တုံ့ပြန်မှုအရှိန်သည်ကြီးမားနိုင်သည်။ ဥပမာအားဖြင့် enotme orotidine-5'-phosphate decarboxylase အင်ဇိုင်းအားဖြင့်ဓာတ်ကူပေးသောတုံ့ပြန်မှုသည်အင်ဇိုင်းမပါ ၀ င်ဘဲနှစ်ပေါင်း ၇၈ သန်းနှင့်အင်ဇိုင်းပါဝင်မှုမရှိဘဲ ၁၈ မီလီလီယမ်ပါဝင်သည်။ တုံ့ပြန်မှု၏ရလဒ်အဖြစ်အင်ဇိုင်းနှင့်ဆက်သွယ်နှင့်ပြောင်းလဲသောမော်လီကျူးများကိုအလွှာဟုခေါ်ကြသည်။
အင်ဇိုင်းများတွင်များသောအားဖြင့်အမိုင်နိုအက်ဆစ်အကြွင်းအကျန်များပါ ၀ င်သော်လည်း၎င်းတို့ထဲမှအနည်းငယ်မျှသာအလွှာနှင့်အပြန်အလှန်ဆက်သွယ်ကြပြီး၊ သေးငယ်သည့်ပမာဏပင် - ပျှမ်းမျှအားဖြင့်အများအားဖြင့်မူလဖွဲ့စည်းတည်ဆောက်ပုံတွင်တစ် ဦး နှင့်တစ် ဦး ဝေးကွာသောအမိုင်နိုအက်ဆစ်အကြွင်းအကျန် ၃ ခုသည်ဓာတ်ကူပစ္စည်းတွင်တိုက်ရိုက်ပါ ၀ င်သည်။ အလွှာနှင့်ဓာတ်ကူပစ္စည်းကိုပေါင်းစပ်ပေးသောအင်ဇိုင်းမော်လီကျူး၏အစိတ်အပိုင်းကိုတက်ကြွသောဗဟိုဟုခေါ်သည်။
၁၉၉၂ ခုနှစ်တွင်အပြည်ပြည်ဆိုင်ရာဇီဝဓါတုဗေဒနှင့်မော်လီကျူးဇီဝဗေဒဆိုင်ရာသမဂ္ဂသည်၎င်းတို့မှဓာတ်ပြုတုံ့ပြန်မှုအမျိုးအစားပေါ် အခြေခံ၍ အဆင့်မြင့်အင်ဇိုင်းများ၏အဆင့်မြင့် nomenclature ၏နောက်ဆုံးမူကိုအဆိုပြုခဲ့သည်။ ဤ nomenclature အရ၊ အင်ဇိုင်းများ၏အမည်များသည်အမြဲတမ်းအဆုံးသတ်ရမည် -အခြေခံ နှင့်ဓာတ်ကူပစ္စည်းတုံ့ပြန်မှုများ၏အမည်များနှင့်၎င်းတို့၏အလွှာကနေဖွဲ့စည်းထားပါသည်။ တစ်ခုချင်းစီကိုအင်ဇိုင်းတစ် ဦး ချင်းစီကုဒ်တာဝန်ပေးအပ်သည်ကအင်ဇိုင်းများ၏အဆင့်ဆင့်အတွက်၎င်း၏အနေအထားကိုဆုံးဖြတ်ရန်လွယ်ကူသောအားဖြင့်။ဓာတ်ကူပစ္စည်းအဖြစ်အပျက်အရအင်ဇိုင်းများအားလုံးကိုအဆင့် ၆ ဆင့်ခွဲခြားထားသည်။
- CF 1: redox တုံ့ပြန်မှု catalyze ကြောင်း oxidoreductases,
- CF 2: အလွှာတစ်ခုမှတစ်ခုသို့အခြားတစ်ခုသို့ဓာတုဗေဒဆိုင်ရာအုပ်စုများကိုပြောင်းရွှေ့မှုကိုအထောက်အကူပြုစေသော Transferases၊
- CF 3: ဓာတုနှောင်ကြိုးများ၏ hydrolysis ဓာတ်ကူပစ္စည်း Hydrolases,
- CF 4: ထုတ်ကုန်များထဲမှနှစ်ဆနှောင်ကြိုးဖွဲ့စည်းခြင်းနှင့်အတူ hydrolysis မရှိဘဲဓာတုနှောင်ကြိုးများ၏ပြိုကွဲ catalyzing Lyases,
- CF 5: အလွှာမော်လီကျူး၏ဖွဲ့စည်းတည်ဆောက်ပုံသို့မဟုတ်ဂျီ ometric မေတြီပြောင်းလဲမှုများကို catalyze သော Isomerases,
- CF 6: ATP diphosphate နှောင်ကြိုးသို့မဟုတ်အလားတူ triphosphate ၏ hydrolysis ကြောင့်အလွှာများအကြားဓာတုနှောင်ကြိုးဖွဲ့စည်းခြင်းကိုဖြစ်ပေါ်စေသည့် Ligases ။
ဖွဲ့စည်းတည်ဆောက်ပုံ function ကို
အဆိုပါ cytoskeleton ၏ဖွဲ့စည်းတည်ဆောက်ပုံပရိုတိန်း, armature တစ် ဦး ကြင်ကြင်နာနာအဖြစ်, ဆဲလ်ပုံသဏ္andာန်နှင့်များစွာသော organoids နှင့်ဆဲလ်များ၏ပုံသဏ္changingာန်ပြောင်းလဲခြင်းတွင်ပါဝင်ပတ်သက်နေကြသည်။ ဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာပရိုတိန်းအများစုသည်အချည်မျှင်များဖြစ်သည်။ actin နှင့် tubulin monomers များသည်ဥပမာအားဖြင့် globular ပျော်ဝင်နေသောပရိုတိန်းများဖြစ်သည်။ သို့သော် polymerization ပြီးနောက် cytoskeleton ကိုဖွဲ့စည်းထားသောဆဲလ်များကိုပုံသဏ္shapeာန်ဆက်လက်ထိန်းသိမ်းစေသည်။ Collagen နှင့် Elastin တို့သည်ချိတ်ဆက်ထားသောတစ်ရှူးများ (ဥပမာအရိုးနု) ၏အဓိကအစိတ်အပိုင်းများဖြစ်ပြီးဆံပင်၊ လက်သည်း၊ ငှက်မွှေးများနှင့်အချို့အခွံများသည် keratin ဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာပရိုတင်းတစ်ခုနှင့်ဖွဲ့စည်းထားသည်။

အကာအကွယ် function ကို
ပရိုတိန်း၏အကာအကွယ်လုပ်ဆောင်မှုအမျိုးအစားများစွာရှိသည်။
- ရုပ်ပိုင်းဆိုင်ရာကာကွယ်မှု။ ခန္ဓာကိုယ်၏ကာယပိုင်းဆိုင်ရာကာကွယ်မှုကိုကော်လာဂျင် (ပရိုတင်း) ကဆက်သွယ်ပေးသောတစ်ရှူးများ (အရိုးများ၊ အရိုးနု၊ အရိုးများနှင့်အရေပြား၏နက်ရှိုင်းသောအလွှာများ (အရေပြား))၊ ကာရက်တီနိတ်ဓာတ်များဖြင့်ဖွဲ့စည်းထားသည်။ ပုံမှန်အားဖြင့်, ထိုကဲ့သို့သောပရိုတိန်းဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာ function ကိုအတူပရိုတိန်းအဖြစ်ထည့်သွင်းစဉ်းစားနေကြသည်။ ဤအုပ်စုရှိပရိုတိန်းဥပမာများသည်သွေးခဲခြင်းတွင်ပါဝင်သော fibrinogen နှင့် thrombin ဖြစ်သည်။
- ဓာတုကာကွယ်စောင့်ရှောက်ရေး။ အဆိပ်၏ပရိုတိန်းမော်လီကျူးများနှင့်စည်းနှောင်ခြင်းသည်သူတို့၏ detoxification ကိုဖြစ်စေသည်။ လူတို့၏ detoxification တွင်အထူးအရေးကြီးသောအခန်းကဏ္ liver သည်အသည်းအင်ဇိုင်းများကအဆိပ်များကိုဖြိုခွဲနိုင်သည်သို့မဟုတ်၎င်းတို့ကိုပျော်ဝင်နေသောပုံစံအဖြစ်သို့ပြောင်းလဲပေးသည်။ ၎င်းသည်ခန္ဓာကိုယ်မှအလျင်အမြန်ဖယ်ထုတ်နိုင်စေသည်။
- ကိုယ်ခံစွမ်းအားကာကွယ်ရေး။ သွေးနှင့်အခြားခန္ဓာအရည်များပါဝင်သောပရိုတင်းများသည်ခန္ဓာကိုယ်၏ခုခံအားစနစ်အားရောဂါဖြစ်ပွားစေသောရောဂါများနှင့်တိုက်ခိုက်မှုများကိုကာကွယ်ပေးသည်။ ဖြည့်စွက်စနစ်ပရိုတိန်းများနှင့်ပantibိပစ္စည်းများ (immunoglobulins) သည်ဒုတိယအုပ်စု၏ပရိုတိန်းများနှင့်သက်ဆိုင်သည်၊ ဗက်တီးရီးယားများ၊ ဗိုင်းရပ်စ်များသို့မဟုတ်တိုင်းတစ်ပါးပရိုတိန်းများကိုပျက်ပြားစေသည်။ ခန္ဓာကိုယ်တွင်းရှိအရာဝတ္ထုများ၊ အင်တီဂျင်များနှင့်ချိတ်ဆက်ပြီးသန္ဓေတည်ခြင်းဆိုင်ရာကိုယ်ခံအားစနစ်၏အစိတ်အပိုင်းတစ်ခုဖြစ်သည့်ပibိပစ္စည်းများသည်ဖျက်ဆီးခြင်းနေရာများသို့ပို့ဆောင်ပေးသည်။ ပibိပစ္စည်းများကို intercellular အာကာသအတွင်းသို့လျှို့ဝှက်။ သော်လည်းကောင်း plasmocytes ဟုခေါ်သောအထူး B-lymphocytes များ၏အမြှေးပါးများတွင်တပ်ဆင်နိုင်သည်။
စည်းမျဉ်း function ကို
ဆဲလ်အတွင်းရှိဖြစ်စဉ်များစွာသည်စွမ်းအင်အရင်းအမြစ်မဟုတ်သကဲ့သို့ဆဲလ်အတွက်ဆောက်လုပ်ရေးပစ္စည်းဖြစ်သောပရိုတိန်းမော်လီကျူးများကထိန်းချုပ်သည်။ ဤပရိုတိန်းများသည်ဆဲလ်သံသရာအတွင်းတိုးတက်မှု၊ ကူးယူခြင်း၊ ဘာသာပြန်ခြင်း၊ splicing၊ အခြားပရိုတင်းများ၏လုပ်ဆောင်မှုနှင့်အခြားလုပ်ငန်းစဉ်များတွင်ထိန်းညှိပေးသည်။ ပရိုတိန်းများသည်စည်းမျဉ်းစည်းကမ်းများကိုလုပ်ဆောင်သည် (ဥပမာ - ပရိုတင်း kinases)၊ သို့မဟုတ်အခြားမော်လီကျူးများနှင့်သက်ဆိုင်သောကြောင့်ဖြစ်သည်။ ထို့ကြောင့်ကူးယူအချက်များ, activator ပရိုတိန်းနှင့် repressor ပရိုတိန်း, သူတို့ရဲ့စည်းမျဉ်းပာမှစည်းနှောင်ခြင်းအားဖြင့်မျိုးဗီဇ၏ကူးယူပြင်းထန်မှုကိုထိန်းညှိနိုင်ပါတယ်။ ဘာသာပြန်သည့်အဆင့်တွင် mRNAs များစွာ၏စာဖတ်ခြင်းကိုပရိုတိန်းအချက်များထပ်ပေါင်းခြင်းဖြင့်လည်းထိန်းချုပ်သည်။
ဆဲလ်ဖြစ်စဉ်များ၏စည်းမျဉ်းစည်းကမ်းများတွင်အရေးအပါဆုံးအခန်းကဏ္ protein သည်ပရိုတိန်း kinases နှင့် protein phosphatases များဖြစ်သည်။ အခြားပရိုတင်းများ၏လုပ်ဆောင်မှုကို၎င်းတို့နှင့်ချိတ်ဆက်ခြင်းသို့မဟုတ်ဖော့စဖိတ်အုပ်စုများကိုခွဲထုတ်ခြင်းဖြင့်အခြားပရိုတင်းများ၏လုပ်ဆောင်မှုကိုဟန့်တားပေးသည့်အင်ဇိုင်းများဖြစ်သည်။

အချက်ပြ function ကို
ပရိုတိန်း၏အချက်ပြမှုသည်ပရိုတိန်း၏ပစ္စည်းများကိုအချက်ပြပစ္စည်းအဖြစ်အသုံးပြုရန်၊ ဆဲလ်များ၊ တစ်သျှူးများ၊ များစွာသော intracellular စည်းမျဉ်းပရိုတိန်းကိုလည်းအချက်ပြထုတ်လွှင့်ကတည်းကမကြာခဏဆိုသလို, signal ကို function ကို, စည်းမျဉ်းတ ဦး တည်းနှင့်အတူပေါင်းစပ်ထားသည်။
အချက်ပြ function ကိုဟော်မုန်းပရိုတိန်း, cytokines, ကြီးထွားအချက်များ, etc ကလုပ်ဆောင်သည်
ဟော်မုန်းကိုသွေးဖြင့်သယ်ဆောင်သည်။ တိရိစ္ဆာန်ဟော်မုန်းအများစုသည်ပရိုတင်းသို့မဟုတ် peptides များဖြစ်သည်။ ဟော်မုန်းကိုအဲဒီ receptor နဲ့ဆက်သွယ်မှုကဆဲလ်တုံ့ပြန်မှုကိုအစပြုပေးတယ်။ ဟော်မုန်းများသည်သွေးနှင့်ဆဲလ်များရှိအရာဝတ္ထုများ၏အာရုံစူးစိုက်မှု၊ ကြီးထွားမှု၊ မျိုးပွားမှုနှင့်အခြားဖြစ်စဉ်များကိုထိန်းညှိသည်။ ထိုကဲ့သို့သောပရိုတင်းများဥပမာတစ်ခုသည်သွေးထဲရှိဂလူးကို့စ်၏အာရုံစူးစိုက်မှုကိုထိန်းညှိသောအင်ဆူလင်ဖြစ်သည်။
ဆဲလ်များသည်အချင်းချင်းဆက်သွယ်မှုပြုသည်။ ထိုကဲ့သို့သောပရိုတိန်းဥပမာ, cytokines နှင့်ကြီးထွားအချက်များပါဝင်သည်။
cytokines peptide အချက်ပြမော်လီကျူးများဖြစ်ကြသည်။ သူတို့ကဆဲလ်များအကြားအပြန်အလှန်ထိန်းညှိမှု, သူတို့ရဲ့ရှင်သန်ရပ်တည်ရေးဆုံးဖြတ်ရန်, ကြီးထွားမှု, ကွဲပြားခြားနားမှု, အလုပ်လုပ်တဲ့လှုပ်ရှားမှုနှင့် apoptosis လှုံ့ဆော်သို့မဟုတ်တားစီး, ကိုယ်ခံစွမ်းအား, endocrine နှင့်အာရုံကြောစနစ်များ၏ညှိနှိုင်းသေချာ။ cytokines ၏ဥပမာတစ်ခုမှာခန္ဓာကိုယ်၏ဆဲလ်များအကြားရောင်ရမ်းခြင်းအချက်ပြမှုကိုပေးသောအကျိတ် necrosis အချက်ဖြစ်သည်။
အပို (standby) function ကို
၎င်းပရိုတင်းများသည်အပင်များ၏မျိုးစေ့များ (ဥပမာ 7S နှင့် 11S globulins) နှင့်တိရိစ္ဆာန်ဥများတွင်စွမ်းအင်နှင့်ပစ္စည်းအဖြစ်အရင်းအမြစ်အဖြစ်သိုလှောင်ထားသည့်အရံပရိုတင်းများဟုခေါ်သည်။ အခြားပရိုတိန်းများစွာကိုခန္ဓာကိုယ်ထဲတွင်အမိုင်နိုအက်ဆစ်၏အရင်းအမြစ်အဖြစ်အသုံးပြုသည်။ ၎င်းသည်ဇီဝတက်ကြွသောအရာဝတ္ထုများ၏ရှေ့ပြေးဖြစ်သည့်ဇီဝဖြစ်စဉ်ဖြစ်စဉ်များကိုထိန်းချုပ်သည်။

Receptor function ကို
ပရိုတိန်းဓာတ်လက်ခံမှုကို cytoplasm တွင်တည်ရှိပြီးဆဲလ်အမြှေးပါးသို့ပေါင်းစည်းနိုင်သည်။ အဲဒီ receptor မော်လီကျူးရဲ့အစိတ်အပိုင်းတစ်ခုက signal ကိုလက်ခံတယ်။ သူကများသောအားဖြင့်ဓာတုပစ္စည်းတစ်ခုကပေးလေ့ရှိပြီးအချို့ကိစ္စရပ်များမှာအလင်း၊ စက်မှုစိတ်ဖိစီးမှု (ဥပမာ၊ ဆန့်ခြင်း) နှင့်အခြားလှုံ့ဆော်မှုများဖြစ်သည်။ signal ကိုမော်လီကျူး၏တိကျသောအစိတ်အပိုင်းတစ်ခုဖြစ်သော receptor protein နှင့်ထိတွေ့သောအခါ၎င်းသည်ပြောင်းလဲမှုဖြစ်ပေါ်သည်။ ရလဒ်အနေဖြင့်အခြားဆဲလ်အစိတ်အပိုင်းများကိုအချက်ပြသည့်မော်လီကျူး၏အခြားအစိတ်အပိုင်းတစ်ခု၏ပြောင်းလဲမှုသည်ပြောင်းလဲသွားသည်။ အများအပြားအချက်ပြဂီယာယန္တရားများရှိပါသည်။ အချို့သော receptors များသည်ဓာတုဓာတ်ပြုမှုအချို့ကိုဓာတ်ကူပစ္စည်းအဖြစ်ပြုလုပ်ပေးသည်။ အချို့သည်အိုင်းယွန်းလိုင်းများအဖြစ်ဆောင်ရွက်သည်။ အချက်ပြ၏လုပ်ဆောင်ချက်ကိုဖွင့်နိုင်သည်။ အမြှေးပါး receptors မှာ signal မော်လီကျူးနဲ့ချိတ်ဆက်ထားတဲ့မော်လီကျူးရဲ့အစိတ်အပိုင်းဟာဆဲလ်ရဲ့မျက်နှာပြင်ပေါ်မှာဖြစ်ပြီး signal ကို transmit လုပ်တဲ့ domain ကအတွင်းပိုင်းဖြစ်တယ်။
မော်တာ (မော်တာ) function ကို
မော်တာပရိုတိန်းတစ်ခုလုံးသည်ခန္ဓာကိုယ်လှုပ်ရှားမှုများကိုထောက်ပံ့ပေးသည်။ ဥပမာအားဖြင့်ကြွက်သားကျုံ့ခြင်း (myosin)၊ ခန္ဓာကိုယ်အတွင်းရှိဆဲလ်များလှုပ်ရှားမှု (ဥပမာ - amoeboid leukocytes လှုပ်ရှားမှု)၊ cilia နှင့် flagella လှုပ်ရှားမှု၊ ။ Dyneins နှင့် kinesins တို့သည် ATP hydrolysis ကိုစွမ်းအင်အရင်းအမြစ်အဖြစ် အသုံးပြု၍ microtubules များတစ်လျှောက်မော်လီကျူးများကိုသယ်ဆောင်သည်။ Dyneins များသည်ဆဲလ်၏အရံအစိတ်အပိုင်းများမှမော်လီကျူးများနှင့် organelles များကိုဆန့်ကျင်ဘက် ဦး တည်ချက်သို့ centrosome၊ kinesins ဆီသို့လွှဲပြောင်းပေးသည်။ eyaryote ၏ cilia နှင့် flagella များ၏လှုပ်ရှားမှုအတွက် Dyneins များသည်လည်းတာဝန်ရှိသည်။ myosin ၏ cytoplasmic မျိုးကွဲ microfilaments မှတဆင့်မော်လီကျူးများနှင့် organoids သယ်ယူပို့ဆောင်ရေးတွင်ပါဝင်ပတ်သက်နိုင်ပါသည်။
ဇီဝြဖစ်အတွက်ပရိုတိန်း
သေးငယ်သောဇီ ၀ သက်ရှိများနှင့်အပင်အများစုသည် citrulline ကဲ့သို့သောအမိုင်နိုအက်ဆစ် ၂၀ အပြင်အပို (Non-standard) အမိုင်နိုအက်ဆစ်များကိုစုစည်းနိုင်သည်။အမိုင်နိုအက်ဆစ်များသည်ပတ်ဝန်းကျင်တွင်ရှိပါကသေးငယ်သောသက်ရှိများသည်ပင်အမိုင်နိုအက်ဆစ်များကိုဆဲလ်များသို့သယ်ယူပို့ဆောင်ခြင်းနှင့်သူတို့၏ biosynthetic လမ်းကြောင်းများပိတ်ခြင်းဖြင့်စွမ်းအင်ကိုထိန်းသိမ်းသည်။
တိရိစ္ဆာန်များမှ ဖန်တီး၍ မရနိုင်သည့်အမိုင်နိုအက်ဆစ်များကိုမရှိမဖြစ်လိုအပ်သည်။ biosynthetic လမ်းကြောင်းများရှိအဓိကအင်ဇိုင်းများ၊ ဥပမာ aspartate မှ aspartate kinase, aspartate မှ lysine, methionine နှင့် threonine ဖွဲ့စည်းမှုအတွက်ခြေလှမ်းများသည်တိရိစ္ဆာန်များတွင်မရှိခြင်း။
တိရစ္ဆာန်များသည်အများအားဖြင့်အစာ၌တွေ့ရသောပရိုတင်းများမှအမိုင်နိုအက်ဆစ်များကိုရကြသည်။ အစာခြေနေစဉ်ပရိုတင်းများကိုဖျက်ဆီးပစ်သည်၊ ၎င်းသည်အများအားဖြင့်ပရိုတိန်း၏ denaturation ဖြင့်အက်ဆစ်ပတ်ဝန်းကျင်တွင်နေရာ ချ၍ ပရိုတင်းဓာတ်ဟုခေါ်သောအင်ဇိုင်းများကို အသုံးပြု၍ hydrolyzing ဖြင့်ပြုလုပ်သည်။ အစာခြေခြင်းကြောင့်ရရှိသောအမိုင်နိုအက်ဆစ်အချို့သည်ခန္ဓာကိုယ်ပရိုတိန်းများစုစည်းမှုအတွက်အသုံးပြုသည်၊ ကျန်ကြွင်းသောအရာများသည်ဂလူးကို့နိုဂျင်နိုက်စ်အတွင်းဂလူးကို့စ်အဖြစ်သို့ပြောင်းလဲသွားသည်သို့မဟုတ်ခရက်ဘ်သံသရာတွင်အသုံးပြုသည်။ ခန္ဓာကိုယ်၏ပရိုတိန်းများအထူးသဖြင့်ကြွက်သားများစွမ်းအင်အရင်းအမြစ်အဖြစ်ဆောင်ရွက်သောအခါအစာရှောင်ခြင်းအခြေအနေတွင်ပရိုတိန်းကိုစွမ်းအင်အရင်းအမြစ်အဖြစ်အသုံးပြုခြင်းသည်အထူးအရေးကြီးသည်။ အမိုင်နိုအက်ဆစ်များသည်ခန္ဓာကိုယ်၏အာဟာရအတွက်အရေးပါသောနိုက်ထရိုဂျင်အရင်းအမြစ်လည်းဖြစ်သည်။
လူ့ပရိုတိန်းစားသုံးမှုအတွက်စုစည်းထားသောစံနှုန်းများမရှိပါ။ အူမကြီး၏ microflora သည်ပရိုတိန်းစံနှုန်းများကိုပြင်ဆင်ခြင်းတွင်ထည့်သွင်းစဉ်းစားခြင်းမရှိသောအမိုင်နိုအက်ဆစ်များကိုဖန်တီးသည်။
လေ့လာမှုနည်းလမ်းများ
ပရိုတိန်း၏ဖွဲ့စည်းတည်ဆောက်ပုံနှင့်လုပ်ဆောင်ချက်များကိုသန့်စင်သောပြင်ဆင်မှုများတွင်လေ့လာသည် စသည်တို့ဖြစ်သည်နှင့်သက်ရှိသက်ရှိရှိသူတို့၏သဘာဝပတ်ဝန်းကျင်၌ t vivo အတွက်။ ထိန်းချုပ်ထားသောအခြေအနေများအောက်ရှိစင်ကြယ်သောပရိုတိန်းများကိုလေ့လာခြင်းသည် ၄ င်းတို့၏လုပ်ဆောင်ချက်များကိုဆုံးဖြတ်ရာတွင်အသုံးဝင်သည်။ အင်ဇိုင်းများ၏ဓာတ်ကူပစ္စည်းလှုပ်ရှားမှု၊ အရာအလွှာအမျိုးမျိုးအတွက်ဆွေမျိုးမျိုးစပ်ခြင်းစသည်တို့ဖြစ်သည်။ vivo အတွက် ဆဲလ်များ (သို့) သက်ရှိတစ်ခုလုံးတွင်၎င်းတို့လုပ်ဆောင်သည့်နေရာနှင့်၎င်းတို့၏လုပ်ဆောင်မှုများကိုမည်သို့ထိန်းညှိသည်ဟူသောအပိုဆောင်းအချက်အလက်များကိုပေးသည်။
မော်လီကျူးနှင့်ဆယ်လူလာဇီဝဗေဒ

မော်လီကျူးနှင့်ဆယ်လူလာဇီဝဗေဒဆိုင်ရာနည်းစနစ်များကိုဆဲလ်တစ်ခုအတွင်းရှိပရိုတိန်းများစုစည်းခြင်းနှင့်နေရာချထားခြင်းများကိုလေ့လာရန်အသုံးပြုသည်။ ဒေသအလိုက်လေ့လာခြင်းနည်းလမ်းကိုဆဲလ်အတွင်းရှိ chimeric ပရိုတိန်း၏ပေါင်းစပ်မှုအပေါ် အခြေခံ၍ ကျယ်ပြန့်စွာအသုံးပြုထားသည်။ ဥပမာ - သတင်းထောက်၊ အစိမ်းရောင်ချောင်းပရိုတိန်း (GFP) နှင့်ဆက်သွယ်ထားသည်။ ဆဲလ်အတွင်းရှိထိုကဲ့သို့သောပရိုတိန်း၏တည်နေရာကိုချောင်းအဏုကြည့်မှန်ပြောင်းဖြင့်တွေ့မြင်နိုင်သည်။ ထို့အပြင်ပရိုတိန်းများကို၎င်းတို့အားအသိအမှတ်ပြုသောပusingိပစ္စည်းများကို အသုံးပြု၍ မြင်နိုင်သည်၊ ၎င်းသည်အလှည့်၌ချောင်းကြည့်နေသောအညွှန်းပါရှိသည်။ မကြာခဏဆိုသလိုလေ့လာရသောပရိုတိန်းနှင့်အတူတစ်ပြိုင်နက်တည်းလေ့လာမှုပရိုတိန်း၏ဒေသအလိုက်ပိုမိုတိကျပြဌာန်းခွင့်ခွင့်ပြုထားတဲ့ endoplasmic reticulum, Golgi ယန္တရား, lysosomes နှင့် vacuoles ကဲ့သို့သော organelles ၏မကြာခဏလူသိများပရိုတိန်းမြင်နေကြသည်။
Immunohistochemical နည်းလမ်းများသည်များသောအားဖြင့်တောက်ပသောရောင်စုံထုတ်ကုန်များဖြစ်ပေါ်လာစေသည့်အင်ဇိုင်းများနှင့်ပေါင်းစပ်ထားသောပantibိပစ္စည်းများကိုအသုံးပြုသည်။ ၎င်းသည်နမူနာများတွင်လေ့လာထားသောပရိုတိန်း၏တည်နေရာနှင့်ပမာဏကိုနှိုင်းယှဉ်နိုင်သည်။ ပရိုတိန်းများ၏တည်နေရာကိုဆုံးဖြတ်ရန် ပိုမို၍ ရှားပါးသောနည်းမှာဆဲလ်အပိုင်းအစများကို equilibrium ultracentrifugation ပြုလုပ်သောကြောင့် sucrose (သို့) cesium chloride ၏ gradient ဖြစ်သည်။
နောက်ဆုံးအနေနှင့်ဂန္ထဝင်နည်းလမ်းများထဲမှတစ်ခုမှာ immuno-electronic microscopy ဖြစ်သည်။ ၎င်းသည် immunofluorescence microscopy နှင့်အခြေခံအားဖြင့်အီလက်ထရွန်အဏုကြည့်မှန်ပြောင်းကိုအသုံးပြုသည့်ခြားနားချက်ဖြစ်သည်။ နမူနာသည်အီလက်ထရွန်မိုက်ခရိုစကုပ်အတွက်ပြင်ဆင်သည်၊ ထို့နောက်အီလက်ထရွန်သိပ်သည်းသောပစ္စည်း၊ များသောအားဖြင့်ရွှေနှင့်ချိတ်ဆက်ထားသောပရိုတိန်းနှင့်ပantibိပစ္စည်းများကိုထုတ်လုပ်သည်။
site ကို - ဦး တည် mutagenesis ကိုအသုံးပြု။ သုတေသီများပရိုတိန်း၏အမိုင်နိုအက်ဆစ် sequence ကိုနှင့်အကျိုးဆက်၎င်း၏ Spatial ဖွဲ့စည်းပုံ, ဆဲလ်အတွင်းတည်နေရာနှင့်၎င်း၏လှုပ်ရှားမှု၏စည်းမျဉ်းကိုပြောင်းလဲနိုင်သည်။ ဤနည်းလမ်းကိုအသုံးပြုခြင်းအားဖြင့်ပြုပြင်ထားသော tRNAs ကို သုံး၍ အတုအမိုင်နိုအက်ဆစ်များကိုပရိုတိန်းထဲသို့မိတ်ဆက်နိုင်သည်။
ထဲကဓာတုပစ်စညျး
ခွဲခြမ်းစိတ်ဖြာလုပ်ဆောင်ရန် စသည်တို့ဖြစ်သည် ပရိုတိန်းသည်အခြားဆယ်လူလာအစိတ်အပိုင်းများမှသန့်စင်ရမည်။ ဤလုပ်ငန်းစဉ်သည်များသောအားဖြင့်ဆဲလ်များကိုဖျက်ဆီးခြင်းနှင့်ဆဲလ်ထုတ်ယူမှုဟုခေါ်သည့်အရာမှစတင်သည်။ ထို့အပြင် centrifugation နှင့် ultracentrifugation နည်းလမ်းများအားဖြင့်, ဒီထုတ်ယူခွဲခြားနိုင်ပါသည်: ပျော်ဝင်ပရိုတိန်း, အမြှေးပါး lipids နှင့်ပရိုတိန်းများပါဝင်သောအစိတ်အပိုင်းနှင့်ဆယ်လူလာ organelles နှင့် nucleic acids များပါဝင်သောအစိတ်အပိုင်း။

ဆားထွက်ခြင်းဖြင့်ပရိုတိန်းမိုးရွာသွန်းမှုကိုပရိုတိန်းအရောအနှောများခွဲထုတ်ရာတွင်အသုံးပြုသည်။ အနည်ထိုင်နိုင်သောခွဲခြမ်းစိတ်ဖြာခြင်း (centrifugation) သည်ပရိုတိန်းတစ်မျိုးချင်း၏အနည်ထိုင်သည့်စဉ်ဆက်မပြတ်တန်ဖိုးကို svedberg (S) ဖြင့်တိုင်းတာနိုင်သည်။ အမျိုးမျိုးသော Chromatography အမျိုးအစားများကိုမော်လီကျူးအလေးချိန်၊ တာဝန်ခံနှင့်ဆှဖှေဲ့စသည့်ဂုဏ်သတ္တိများအပေါ် အခြေခံ၍ အလိုရှိသောပရိုတိန်းသို့မဟုတ်ပရိုတိန်းများကိုခွဲထုတ်ရန်အသုံးပြုသည်။ ထို့အပြင်ပရိုတိန်းများကို electroocus သုံး၍ ၎င်းတို့၏ charging အရခွဲထုတ်နိုင်သည်။
ပရိုတိန်းသန့်စင်ခြင်းလုပ်ငန်းစဉ်ကိုရိုးရှင်းစေရန်အတွက်မျိုးရိုးဗီဇဆိုင်ရာအင်ဂျင်နီယာကိုမကြာခဏအသုံးပြုလေ့ရှိပြီး၎င်းသည်သူတို့၏ဖွဲ့စည်းပုံနှင့်လုပ်ဆောင်မှုကိုမထိခိုက်စေဘဲသန့်စင်မှုအတွက်အဆင်ပြေသောပရိုတင်းဓာတ်များကိုဖန်တီးနိုင်သည်။ "Labels"၊ အမိုင်နိုအက်ဆစ်ပာအစဉ်လိုက်များဖြစ်သောဥပမာ ၆ ခုထက်ပိုသော histidine အကြွင်းအကျန်များနှင့်ပရိုတိန်း၏အဆုံးတစ်ခုနှင့်တွဲထားသည်။ "တံဆိပ်ကပ်ထားသော" ပရိုတိန်းများကိုဆဲလ်များထုတ်ယူသောအက်တမ်များကိုနီကယ်အိုင်းယွန်းများပါ ၀ င်သော chromatographic ကော်လံမှတဆင့်သွားသောအခါ histidine သည်နီကယ်နှင့်ချည်နှောင်ပြီးကော်လံတွင်ကျန်ရှိနေသေးသည်။ များစွာသောအခြားတံဆိပ်များကိုသုတေသီများသည်ရှုပ်ထွေးသောအရောအနှောများမှတိကျသောပရိုတင်းများကိုသီးခြားခွဲထုတ်ခြင်းမှကူညီရန်ဒီဇိုင်းရေးဆွဲထားပြီးအများစုမှာ affinity chromatography ကိုအသုံးပြုသည်။
ပရိုတိန်းသန့်စင်မှု၏အတိုင်းအတာကို၎င်း၏မော်လီကျူးအလေးချိန်နှင့် isoelectric point များသိရှိပါက - gel gel electrophoresis အမျိုးမျိုးကို အသုံးပြု၍ သော်လည်းကောင်းပရိုတိန်းသည်အင်ဇိုင်းတစ်ခုဖြစ်လျှင်အင်ဇိုင်းပြုမှုလုပ်ဆောင်မှုကိုတိုင်းတာနိုင်သည်။ Mass spectrometry ကရွေးချယ်ထားသောပရိုတိန်းကိုမော်လီကျူးအလေးချိန်နှင့်၎င်း၏အစိတ်အပိုင်းအစများအရခွဲခြားသတ်မှတ်နိုင်သည်။
Proteomics
ဆဲလ်ပရိုတိန်းစုစုပေါင်းကို proteome ဟုခေါ်သည်။ ၎င်းလေ့လာမှု - proteomics ကို Genomics နှင့်နှိုင်းယှဉ်နိုင်သည်။ အဓိကစမ်းသပ် proteomics နည်းလမ်းများပါဝင်သည်
- multicomponent ပရိုတိန်းအရောအနှောများခွဲခြားခွင့်ပြုသည့် 2D electrophoresis,
- မြင့်မားသော throughput နှင့်အတူ၎င်းတို့၏ဖွဲ့စည်းပုံအခြေခံဥပဒေ peptides ၏ဒြပ်ထုအားဖြင့်ပရိုတိန်း၏မှတ်ပုံတင်ခွင့်ပြုထားတဲ့အစုလိုက်အပြုံလိုက် Spectrometry,
- ဆဲလ်ထဲရှိပရိုတိန်းအမြောက်အများကိုတစ်ပြိုင်နက်တည်းတိုင်းတာရန်ခွင့်ပြုထားသောပရိုတိန်း microarrays၊
- နှစ်မျိုးစပ်သောတဆေးစနစ် ပရိုတိန်းနှင့်ပရိုတိန်းများအပြန်အလှန်ဆက်သွယ်မှုကိုစနစ်တကျလေ့လာရန်ခွင့်ပြုသည်။
ဆဲလ်အတွင်းရှိပရိုတိန်းများအားလုံး၏ဇီဝဗေဒအရထူးခြားသောအပြန်အလှန်အကျိုးသက်ရောက်မှုများကိုစုစုပေါင်းကိုအပြန်အလှန်တုံ့ပြန်မှုဟုခေါ်သည်။ ဖြစ်နိုင်ချေရှိသောတတိယအဆင့်ဖွဲ့စည်းပုံများအားကိုယ်စားပြုသည့်ပရိုတင်းများ၏ဖွဲ့စည်းပုံကိုစနစ်တကျလေ့လာခြင်းကိုဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာဂျီနိုမာဟုခေါ်သည်။
ဖွဲ့စည်းပုံခန့်မှန်းခြင်းနှင့်မော်ဒယ်လ်
ကွန်ပျူတာပရိုဂရမ်များ သုံး၍ Spatial ဖွဲ့စည်းပုံကိုခန့်မှန်းခြင်းsilico ၌တည်၏) အဘယ်သူ၏ဖွဲ့စည်းပုံသေးစမ်းသပ်ဆုံးဖြတ်နိုင်ခြင်းမရှိသေးပေပရိုတိန်းမော်ဒယ်များတည်ဆောက်ခွင့်ပြုပါတယ်။ homological မော်ဒယ်လ်အဖြစ်လူသိများဖွဲ့စည်းတည်ဆောက်ပုံဆိုင်ရာကြိုတင်ခန့်မှန်းမှု၏အအောင်မြင်ဆုံးအမျိုးအစား, အ simino ပရိုတိန်းနှင့်အတူအမိုင်နိုအက်ဆစ် sequence ကိုဆင်တူရှိပြီးသား "template ကို" ဖွဲ့စည်းပုံပေါ်တွင်မူတည်သည်။ ပရိုတိန်းများ၏ Spatial ဖွဲ့စည်းပုံကိုကြိုတင်ခန့်မှန်းများအတွက်နည်းလမ်းများပရိုတိန်း၏မျိုးရိုးဗီဇအင်ဂျင်နီယာ၏ဖွံ့ဖြိုးဆဲလယ်ပြင်၌, ပရိုတိန်း၏အသစ်သောတက္ကသိုလ်အဆောက်အ ဦ များရရှိပြီးသားရသော၏အကူအညီဖြင့်အသုံးပြုကြသည်။ ပိုမိုရှုပ်ထွေးသောတွက်ချက်မှုဆိုင်ရာလုပ်ငန်းသည်မော်လီကျူးအပြန်အလှန်ဆက်သွယ်ခြင်း၏ခန့်မှန်းချက်ဖြစ်သည့်မော်လီကျူး docking နှင့်ပရိုတိန်းပရိုတိန်းအပြန်အလှန်ဆက်သွယ်မှုများ၏ခန့်မှန်းချက်များဖြစ်သည်။
ပရိုတိန်း၏ခေါက်နှင့် intermolecular interaction ကမော်လီကျူးစက်ပြင်ကိုအသုံးပြု။ လုပ်နိုင်ပါတယ်။ အထူးသဖြင့်မော်လီကျူးဒိုင်းနမစ်နှင့် Monte Carlo နည်းစနစ်သည်အပြိုင်နှင့်ဖြန့်ဝေထားသောကွန်ပျူတာ (ဥပမာ Folding @ home project) ၏အားသာချက်ကိုတိုးမြှင့်ပေးသော Monte Carlo နည်းလမ်းဖြစ်သည်။villin ပရိုတိန်းသို့မဟုတ်အိပ်ချ်အိုင်ဗွီပရိုတိန်းများကဲ့သို့α-helical ပရိုတိန်း domains များခေါက်နိုင်ခြင်းကိုအောင်မြင်စွာပုံစံပြုသည် silico ၌တည်၏။ စံမော်လီကျူးဒိုင်းနမစ်ကိုကွမ်တန်မက်ကန်းနစ်နှင့်ပေါင်းစပ်သည့်စပ်နည်းများကို အသုံးပြု၍ ရူဒင်ဆေး၏အမြင်အာရုံခြယ်ပစ္စည်း၏အီလက်ထရောနစ်အခြေအနေများကိုလေ့လာခဲ့သည်။